Hvor mange valenspositioner har ilt til binding?
Her er hvorfor:
* Elektronkonfiguration: Oxygen har en elektronkonfiguration på 1S² 2S²2P⁴. Dette betyder, at det har seks elektroner i sin yderste skal (den 2. skal).
* Valenselektroner: Valenselektronerne er elektronerne i den yderste skal, der er involveret i kemisk binding. Oxygen har seks Valenselektroner.
* octet regel: Oxygen ønsker at opnå en stabil oktet (otte elektroner) i sin yderste skal. For at gøre dette skal det vinde to Flere elektroner.
* binding: Dette betyder, at ilt kan danne to kovalente bindinger og dele to elektroner med andre atomer.
Eksempler:
* I vand (H₂O) danner ilt to enkeltbindinger med to hydrogenatomer.
* I kuldioxid (CO₂) danner ilt to dobbeltbindinger med et carbonatom.
 Varme artikler
Varme artikler
-
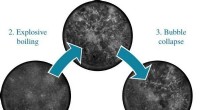 Køler rødglødende stål med varmt vandHøjhastighedsbilleder af køleprocessen. Kredit:Camila Gomez Ph.D. studerende Camila Gomez efterlignede afkølingsprocessen af Tata Steels højovne i laboratoriet og fandt ud af, at det er bedre at
Køler rødglødende stål med varmt vandHøjhastighedsbilleder af køleprocessen. Kredit:Camila Gomez Ph.D. studerende Camila Gomez efterlignede afkølingsprocessen af Tata Steels højovne i laboratoriet og fandt ud af, at det er bedre at -
 Retsmedicinsk kemiker foreslår svedteststrimmel som erstatning for alkometerUniversitetet i Albany retsmedicinsk kemiker Jan Halámek. Kredit:Paul Miller Retsmedicineren Jan Halámek har igen fundet en innovativ anvendelse til menneskelig sved - denne gang for at holde fuld
Retsmedicinsk kemiker foreslår svedteststrimmel som erstatning for alkometerUniversitetet i Albany retsmedicinsk kemiker Jan Halámek. Kredit:Paul Miller Retsmedicineren Jan Halámek har igen fundet en innovativ anvendelse til menneskelig sved - denne gang for at holde fuld -
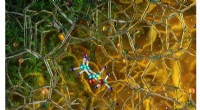 Neutroner optimerer højeffektiv katalysator for en grønnere tilgang til biobrændstofsynteseIllustration af den optimerede zeolitkatalysator (NbAlS-1), som muliggør en højeffektiv kemisk reaktion for at skabe buten, en vedvarende energikilde, uden at bruge store mængder energi til konverteri
Neutroner optimerer højeffektiv katalysator for en grønnere tilgang til biobrændstofsynteseIllustration af den optimerede zeolitkatalysator (NbAlS-1), som muliggør en højeffektiv kemisk reaktion for at skabe buten, en vedvarende energikilde, uden at bruge store mængder energi til konverteri -
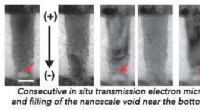 Forskere udvikler faseændringshukommelsesenheder til mere kraftfuld computingEt samarbejde mellem laboratoriet af Judy Cha, Carol og Douglas Melamed adjunkt i maskinteknik og materialevidenskab, og IBMs Watson Research Center kunne hjælpe med at gøre en potentielt revolutioner
Forskere udvikler faseændringshukommelsesenheder til mere kraftfuld computingEt samarbejde mellem laboratoriet af Judy Cha, Carol og Douglas Melamed adjunkt i maskinteknik og materialevidenskab, og IBMs Watson Research Center kunne hjælpe med at gøre en potentielt revolutioner
- Sådan fyldes en vandbarometer eller Storm Glass
- Clinton Hart Merriam
- Hvordan kan skove regenerere uden fugle?
- Hvilke metaller ekstraheres ved hjælp af fytominering?
- Forskere udvikler simpel teknik til at visualisere strukturer i atomare skala
- Peer review proces bedste metode til at bestemme videnskabelig finansiering, undersøgelse finder


