Hvornår er en obligationspolar?
Her er en sammenbrud:
* Elektronegativitet: Dette er et mål for et atoms evne til at tiltrække elektroner mod sig selv i en kemisk binding.
* Forskel i elektronegativitet: Når der er en signifikant forskel i elektronegativitet mellem to bundne atomer, vil den mere elektronegative atom trække de delte elektroner tættere på sig selv. Dette skaber en delvis negativ ladning (Δ-) på det mere elektronegative atom og en delvis positiv ladning (Δ+) på det mindre elektronegative atom.
* polær binding: Denne ulige deling af elektroner fører til en polær binding , hvor den ene ende af bindingen er lidt negativ, og den anden ende er lidt positiv.
Eksempel:
* Bindingen mellem brint (H) og ilt (O) i vand (H₂O) er en polær binding. Oxygen er mere elektronegativ end brint, så det trækker de delte elektroner tættere på sig selv, hvilket gør iltatomet lidt negativt og brintatomerne lidt positive.
Vigtig note:
* Graden af polaritet i en binding bestemmes af forskellen i elektronegativitet mellem atomerne. Jo større forskellen er, jo mere polær er bindingen.
* En obligation betragtes som ikke -polær Når elektronegativitetsforskellen mellem atomerne er meget lille eller nul. Dette forekommer typisk, når de to atomer er det samme element.
Fortæl mig, hvis du gerne vil have flere eksempler eller vil diskutere specifikke obligationer!
 Varme artikler
Varme artikler
-
 Sådan får du ledende geler til at klæbe, når de er våde(A) Billede af en lap-shear test opsætning. Billedkredit:Hyunwoo Yuk, MIT. (B) Billede af klæbemiddelsvigt under en lap-shear test af en våd PEDOT:PSS klæbet på et uberørt glas eller et uberørt glas m
Sådan får du ledende geler til at klæbe, når de er våde(A) Billede af en lap-shear test opsætning. Billedkredit:Hyunwoo Yuk, MIT. (B) Billede af klæbemiddelsvigt under en lap-shear test af en våd PEDOT:PSS klæbet på et uberørt glas eller et uberørt glas m -
 Udvikling af forenklet ny massespektrometrisk teknik ved brug af laser og grafenFormand-professor Dae Won Moon i Institut for Ny Biologi (til venstre) og forskningsstipendiat Jae Young Kim i Institut for Robotteknologi (til højre) Kredit:DGIST En teknologi, der kan opnå høj o
Udvikling af forenklet ny massespektrometrisk teknik ved brug af laser og grafenFormand-professor Dae Won Moon i Institut for Ny Biologi (til venstre) og forskningsstipendiat Jae Young Kim i Institut for Robotteknologi (til højre) Kredit:DGIST En teknologi, der kan opnå høj o -
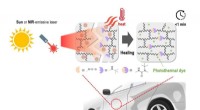 Beskyttende belægningsmateriale heler sig selv på 30 minutter, når det udsættes for sollysSelvhelbredende mekanisme af miljøvenligt beskyttende belægningsmateriale til køretøjer inklusive dynamisk polymernetværk og fototermisk farvestof. Kredit:Korea Research Institute of Chemical Technolo
Beskyttende belægningsmateriale heler sig selv på 30 minutter, når det udsættes for sollysSelvhelbredende mekanisme af miljøvenligt beskyttende belægningsmateriale til køretøjer inklusive dynamisk polymernetværk og fototermisk farvestof. Kredit:Korea Research Institute of Chemical Technolo -
 Forskere skaber ingredienser til at producere mad ved hjælp af 3D-printFødevareingeniører i Brasilien og Frankrig udviklede geler baseret på modificeret stivelse til brug som blæk til fremstilling af fødevarer og nye materialer ved additiv fremstilling. Kredit:Bianca C.
Forskere skaber ingredienser til at producere mad ved hjælp af 3D-printFødevareingeniører i Brasilien og Frankrig udviklede geler baseret på modificeret stivelse til brug som blæk til fremstilling af fødevarer og nye materialer ved additiv fremstilling. Kredit:Bianca C.
- Hvad er de to ureaktive gasser i luften?
- Undersøgelse finder konsensus om at bevæbne skoleressourceofficerer, division om bevæbning af læ…
- Supercomputing mere lys end varme
- Google bliver mere flersproget, men får det nuancen?
- Uddybende spørgsmål:Hvad er et rødt tidevand?
- Hvad er længden af dagen på kviksølv?


