Hvad sker der med saltkrystaller placeret i vand?
1. polaritet og tiltrækning: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (brint) og en lidt negativ ende (ilt). Saltkrystaller er på den anden side lavet af ioner:positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
2. Hydrering: Vandmolekyler tiltrækkes af ionerne i saltkrystallen. De positive ender af vandmolekyler omgiver chloridionerne, og de negative ender omgiver natriumionerne. Denne attraktion kaldes hydrering .
3. Breaking Apart: Den stærke tiltrækning mellem vandmolekylerne og ionerne overvinder de ioniske bindinger, der holder saltkrystallen sammen. Saltkrystallen begynder at gå i stykker og frigiver individuelle ioner i vandet.
4. Løsning: De opløste ioner er nu omgivet af vandmolekyler, hvilket forhindrer dem i at rekombineres til en krystal. Vandet indeholder nu opløst salt, danner en saltopløsning .
Hvad sker der med selve saltkrystallen?
Saltkrystallen vil til sidst forsvinde da det helt opløses i vandet. Størrelsen på krystallen vil gradvist falde, efterhånden som flere og flere ioner frigøres.
Faktorer, der påvirker opløsningen:
* Temperatur: Varmere vand opløser salt hurtigere, fordi den øgede kinetiske energi af molekylerne hjælper med at bryde krystalgitteret lettere.
* omrøring: Røring af vandet hjælper med at bringe friske vandmolekyler i kontakt med saltkrystallen, der accelererer processen.
* Koncentration: Hvis vandet allerede indeholder meget opløst salt, vil det være sværere for mere salt at opløses (mætning).
Vigtig note: Denne proces er reversibel. Hvis du fordamper vandet, vil saltioner rekombere og danne saltkrystaller igen.
Sidste artikelHvornår er en obligationspolar?
Næste artikelHvad er forskellen mellem komprimeret naturgas og gas?
 Varme artikler
Varme artikler
-
 Energibesparelse ved fremstilling af kemikalierDr. Michael Bortz (til venstre) og prof. Karl-Heinz Küfer fra Fraunhofer ITWM modtager Joseph von Fraunhofer-prisen for udviklingen af et analyseværktøj, der kan spare energi i det tocifrede procent
Energibesparelse ved fremstilling af kemikalierDr. Michael Bortz (til venstre) og prof. Karl-Heinz Küfer fra Fraunhofer ITWM modtager Joseph von Fraunhofer-prisen for udviklingen af et analyseværktøj, der kan spare energi i det tocifrede procent -
 Mellemlag hjælper perovskitkrystallisering til højtydende lysemitterende dioderForskellige metaloxidlag påvirker egenskaberne af de tynde perovskitfilm. Kredit:Charlotte Perhammar Forskere ved LiU, der arbejder med kolleger fra Kina, har vist, hvordan man opnår effektive per
Mellemlag hjælper perovskitkrystallisering til højtydende lysemitterende dioderForskellige metaloxidlag påvirker egenskaberne af de tynde perovskitfilm. Kredit:Charlotte Perhammar Forskere ved LiU, der arbejder med kolleger fra Kina, har vist, hvordan man opnår effektive per -
 Forskere i verden afslører først strukturen af et vigtigt lægemiddelmålKredit:Monash University Monash University-forskere har brugt en ny teknik til at afsløre strukturen af et vigtigt lægemiddelmål, åbner vejen for forbedrede behandlinger af kroniske sygdomme som
Forskere i verden afslører først strukturen af et vigtigt lægemiddelmålKredit:Monash University Monash University-forskere har brugt en ny teknik til at afsløre strukturen af et vigtigt lægemiddelmål, åbner vejen for forbedrede behandlinger af kroniske sygdomme som -
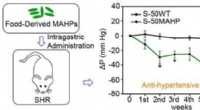 Transgene ris sænker blodtrykket hos hypertensive rotterKredit:American Chemical Society I fremtiden, at tage din blodtryksmedicin kunne være så simpelt som at spise en skefuld ris. Denne behandling kan også have færre bivirkninger end nuværende blodtr
Transgene ris sænker blodtrykket hos hypertensive rotterKredit:American Chemical Society I fremtiden, at tage din blodtryksmedicin kunne være så simpelt som at spise en skefuld ris. Denne behandling kan også have færre bivirkninger end nuværende blodtr
- Synteseundersøgelse viser, at fytoplankton kan blomstre under arktisk havis
- Marine bioplast fremstillet med fiskeaffald, rødalge vinder præmie
- Er teknologibaseret intelligens mere tilbøjelig til at udvikle sig på land eller i vand?
- Hej, Alexa:Undskyld, jeg narre dig
- Hvordan orkaner kan påvirke vejret efter landgang
- Hvor mange arter på Jorden? 8,7 mio


