Hvad er forskellen mellem en isotop og ion af samme element?
isotoper
* Definition: Atomer med det samme element, der har det samme antal protoner (atomnummer), men et andet antal neutroner.
* Nøgleegenskaber:
* Samme atomnummer: Dette definerer elementet.
* Forskellige massenummer: Massenummeret er summen af protoner og neutroner.
* Kemiske egenskaber: Isotoper af det samme element har generelt meget ens kemiske egenskaber, da deres elektronkonfigurationer er de samme.
* Eksempel: Carbon-12 (6 protoner, 6 neutroner) og carbon-14 (6 protoner, 8 neutroner) er isotoper af kulstof.
ioner
* Definition: Atomer eller molekyler, der har opnået eller mistet elektroner, hvilket resulterer i en netto elektrisk ladning.
* Nøgleegenskaber:
* Samme atomnummer: Antallet af protoner forbliver det samme og definerer elementet.
* Forskellige antal elektroner: Dette skaber den positive eller negative ladning.
* Kemiske egenskaber: Ioner har signifikant forskellige kemiske egenskaber sammenlignet med deres neutrale atom -modstykker på grund af ændringen i elektronkonfiguration og ladning.
* Eksempel: Et natriumatom (NA) har 11 protoner og 11 elektroner. Når den mister en elektron, bliver det en natriumion (Na+), der har 11 protoner og 10 elektroner.
I et nøddeskal:
* isotoper adskiller sig i antallet af neutroner, hvilket fører til forskellige atommasser.
* ioner adskiller sig i antallet af elektroner, hvilket fører til en positiv eller negativ ladning.
Lad mig vide, om du gerne vil udforske nogen specifik isotop eller ioneksempler mere detaljeret!
Sidste artikelHvordan fungerer isbjerge?
Næste artikelHvordan kan vi bruge mineralansvarlig?
 Varme artikler
Varme artikler
-
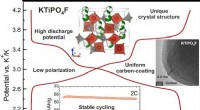 Forskere udvikler et nyt katodemateriale til metal-ion-batterierForskere fra Skoltech Center for Energy Science and Technology (CEST) skabte et nyt katodemateriale baseret på titaniumfluoridfosfat, hvilket muliggjorde opnåelse af overlegen energiydelse og stabil d
Forskere udvikler et nyt katodemateriale til metal-ion-batterierForskere fra Skoltech Center for Energy Science and Technology (CEST) skabte et nyt katodemateriale baseret på titaniumfluoridfosfat, hvilket muliggjorde opnåelse af overlegen energiydelse og stabil d -
 Algoritme forudsiger sammensætninger af nye materialerKredit:CC0 Public Domain En maskinlæringsalgoritme, der kan forudsige sammensætninger af trendmæssige nye materialer, er blevet udviklet af RIKEN-kemikere1. Det vil være nyttigt til at finde mater
Algoritme forudsiger sammensætninger af nye materialerKredit:CC0 Public Domain En maskinlæringsalgoritme, der kan forudsige sammensætninger af trendmæssige nye materialer, er blevet udviklet af RIKEN-kemikere1. Det vil være nyttigt til at finde mater -
 Forbindelser, der giver kaffen sin karakteristiske mundfølelseKredit:Pixabay/CC0 Public Domain Kaffedrikke genkender intuitivt fornøjelsen ved at sluge en glat, rig bryg versus en vandig. Bortset fra tilsat fløde eller sukker, selve kaffen bidrager til denne
Forbindelser, der giver kaffen sin karakteristiske mundfølelseKredit:Pixabay/CC0 Public Domain Kaffedrikke genkender intuitivt fornøjelsen ved at sluge en glat, rig bryg versus en vandig. Bortset fra tilsat fløde eller sukker, selve kaffen bidrager til denne -
 Vil fremtidens superbatterier være lavet af havvand?Kredit:CC0 Public Domain Vi kender alle de genopladelige og effektive lithium-ion (Li-ion) batterier, der sidder i vores smartphones, bærbare computere og også i elbiler. Desværre, lithium er en
Vil fremtidens superbatterier være lavet af havvand?Kredit:CC0 Public Domain Vi kender alle de genopladelige og effektive lithium-ion (Li-ion) batterier, der sidder i vores smartphones, bærbare computere og også i elbiler. Desværre, lithium er en


