Hvad kan der ske med en ideel gas, og hvad ikke gas?
Ideel gas
* Definition: En ideel gas er et teoretisk koncept, hvor partikler antages at have noget volumen og ingen intermolekylære kræfter.
* Nøgleegenskaber:
* Ingen intermolekylære kræfter: Partikler tiltrækker eller afviser ikke hinanden.
* ubetydelig partikelvolumen: Partiklernes volumen er ubetydelig sammenlignet med containervolumen.
* Elastiske kollisioner: Kollisioner mellem partikler er perfekt elastiske, hvilket betyder, at ingen energi går tabt.
* følger den ideelle gaslov: PV =NRT (hvor p =tryk, v =volumen, n =mol, r =ideel gaskonstant, t =temperatur).
* hvad kan der ske?
* udvides og kontrakter frit: Ideelle gasser kan udvide eller kontrahere på ubestemt tid for at fylde deres container.
* følger den ideelle gaslov perfekt: Forholdet mellem tryk, volumen, temperatur og antal mol er altid nøjagtigt beskrevet af den ideelle gaslov.
* konstant varmekapacitet: Mængden af varme, der kræves for at hæve temperaturen på en given mængde gas, er konsekvent.
* hvad kan ikke ske?
* Kondens eller flydende virkning: Ideelle gasser kondenserer aldrig til væsker, uanset hvor meget pres der påføres.
* afvigelse fra ideel opførsel: Ideelle gasser afviger aldrig fra den ideelle gaslov, selv ved høje tryk eller lave temperaturer.
Ægte gas
* Definition: Ægte gasser er de gasser, vi støder på i den virkelige verden. De har en endelig partikelvolumen og oplever intermolekylære kræfter.
* Nøgleegenskaber:
* Intermolekylære kræfter: Partikler tiltrækker eller afviser hinanden (f.eks. Van der Waals kræfter, hydrogenbinding).
* Ikke-ubetydelig partikelvolumen: Volumenet af partiklerne er ikke ubetydeligt, især ved høje tryk.
* Inelastiske kollisioner: Noget energi går tabt under kollisioner.
* hvad kan der ske?
* Kondens og flydendehed: Ægte gasser kan kondensere til væsker eller endda størkne ved visse temperaturer og tryk.
* afvigelse fra ideel opførsel: Ægte gasser afviger fra den ideelle gaslov, især ved høje tryk eller lave temperaturer.
* Variabel varmekapacitet: Varmekapaciteten på en ægte gas kan variere afhængigt af temperatur og tryk.
* hvad kan ikke ske?
* Følg perfekt den ideelle gaslov: Ægte gasser overholder ikke perfekt den ideelle gaslov under alle forhold.
resume
Ideelle gasser er en nyttig teoretisk model til forståelse af gasadfærd, men de er ikke en perfekt repræsentation af virkeligheden. Ægte gasser udviser mere kompleks opførsel på grund af påvirkningen af intermolekylære kræfter og partikelvolumen.
Sidste artikelNedbrydningen af vand kan skabes af?
Næste artikelEr saltvand en homogen eller heterogen?
 Varme artikler
Varme artikler
-
 Forskere laver biologisk nedbrydelige mikroperler af celluloseDr. Janet Scott, Center for bæredygtige kemiske teknologier, University of Bath. Kredit:University of Bath Forskere og ingeniører fra University of Bath har udviklet bionedbrydelige cellulosemikro
Forskere laver biologisk nedbrydelige mikroperler af celluloseDr. Janet Scott, Center for bæredygtige kemiske teknologier, University of Bath. Kredit:University of Bath Forskere og ingeniører fra University of Bath har udviklet bionedbrydelige cellulosemikro -
 Ramanome-databasen kan hjælpe med at udvinde mikroalgecellefabrikker for at reducere kulstofemissio…Maskinindlæring af ramanomer hjælper med at screene mikroalgalcellefabrikker, der reparerer kuldioxid. Kredit:LIU Yang Mikroalger er simple organismer af enkeltceller, Alligevel giver de et stort
Ramanome-databasen kan hjælpe med at udvinde mikroalgecellefabrikker for at reducere kulstofemissio…Maskinindlæring af ramanomer hjælper med at screene mikroalgalcellefabrikker, der reparerer kuldioxid. Kredit:LIU Yang Mikroalger er simple organismer af enkeltceller, Alligevel giver de et stort -
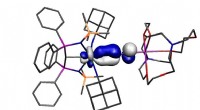 Uran bryder reglerne igenKredit:University of Manchester Arbejde ledet af forskergruppen til professor Steve Liddle og offentliggjort i det prestigefyldte tidsskrift Naturkemi har rapporteret et uranditrogenmolekyle, de
Uran bryder reglerne igenKredit:University of Manchester Arbejde ledet af forskergruppen til professor Steve Liddle og offentliggjort i det prestigefyldte tidsskrift Naturkemi har rapporteret et uranditrogenmolekyle, de -
 Kemiteknik er kædedrev for at skabe bedre syntetiske molekyler til medicinKredit:CC0 Public Domain I en undersøgelse med implikationer for fremtiden for lægemiddelopdagelse, Forskere fra Scripps Research viste, at de var i stand til at omdanne simple kemikalier til unik
Kemiteknik er kædedrev for at skabe bedre syntetiske molekyler til medicinKredit:CC0 Public Domain I en undersøgelse med implikationer for fremtiden for lægemiddelopdagelse, Forskere fra Scripps Research viste, at de var i stand til at omdanne simple kemikalier til unik
- Hvorfor primært alkylhalogenid ikke synteses ved anvendelse af SN1 -reaktion?
- Tidlig klimatilbagebetaling med højere emissionsreduktioner
- Bitcoin-børspræsidentens død sætter millioner uden for rækkevidde
- FORKLARER:Hvordan Ida kan være så dødbringende 1000 miles fra landfald
- Amerika vil opfylde sine klimamål:Bloomberg
- Texas hulesediment opløser meteoritforklaring for global afkøling


