Hvad er fire typer af kimiske reaktioner?
1. kombinationsreaktioner (syntese):
* To eller flere reaktanter kombineres for at danne et enkelt produkt.
* Generel form:A + B → AB
* Eksempel:2 NA (S) + Cl₂ (G) → 2 NaCl (S) (natrium og klor reagerer på dannelsodiumchlorid)
2. nedbrydning af reaktioner:
* En enkelt reaktant opdeles i to eller flere produkter.
* Generel form:AB → A + B
* Eksempel:2 H₂O (L) → 2 H₂ (G) + O₂ (G) (vand nedbrydes til brint og iltgas)
3. enkeltfortrængningsreaktioner:
* Et element erstatter et andet element i en forbindelse.
* Generel form:A + BC → AC + B
* Eksempel:Zn (s) + cuso₄ (aq) → Znso₄ (aq) + cu (s) (zink erstatter kobber i kobbersulfat)
4. dobbeltfortrængningsreaktioner:
* To reaktanter udveksler ioner til dannelse af to nye produkter.
* Generel form:AB + CD → AD + CB
* Eksempel:Agno₃ (aq) + NaCl (aq) → AgCl (s) + nano₃ (aq) (sølvnitrat og natriumchlorid reagerer på form sølvchlorid og natriumnitrat)
Dette er kun et par af de mange typer kemiske reaktioner. Andre vigtige kategorier inkluderer forbrænding, neutralisering og redoxreaktioner.
 Varme artikler
Varme artikler
-
 Fremtiden for cellekultur:En ny kontinuerlig bioproces udvikletSammenligning af den nye overflade til celleproduktion med glasskiven, der producerer den samme mængde celler som 14 traditionelle kolber. Kredit:Newcastle University, Storbritannien En teknik, de
Fremtiden for cellekultur:En ny kontinuerlig bioproces udvikletSammenligning af den nye overflade til celleproduktion med glasskiven, der producerer den samme mængde celler som 14 traditionelle kolber. Kredit:Newcastle University, Storbritannien En teknik, de -
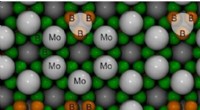 Forskere beregner krystalstruktur af superhårde molybdænboriderAtomarrangement i den højeste molybdænborid (MoB5-x) krystal Kredit:Dmitry V. Rybkovskiy, J. Phys. Chem. Lett. I deres søgen efter nye superhårde forbindelser, forskere har udført en forudsigelse
Forskere beregner krystalstruktur af superhårde molybdænboriderAtomarrangement i den højeste molybdænborid (MoB5-x) krystal Kredit:Dmitry V. Rybkovskiy, J. Phys. Chem. Lett. I deres søgen efter nye superhårde forbindelser, forskere har udført en forudsigelse -
 Opbygning af en bedre biosensorpolymerFlere kritiske udfordringer blev overvundet for at udvikle den nye type polymer, der har et stort potentiale for næste generations biosensorer. Kredit:KAUST; Xavier Pita Der er udviklet et nyt org
Opbygning af en bedre biosensorpolymerFlere kritiske udfordringer blev overvundet for at udvikle den nye type polymer, der har et stort potentiale for næste generations biosensorer. Kredit:KAUST; Xavier Pita Der er udviklet et nyt org -
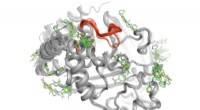 Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundetEn high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs ak
Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundetEn high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs ak


