Hvor mange mol H2O produceres, når 0,468 mol octan brændes?
1. Skriv den afbalancerede kemiske ligning for forbrænding af oktan:
C₈H₁₈ + 25/2 O₂ → 8 CO₂ + 9 H₂O
2. Bestem molforholdet mellem oktan og vand:
Fra den afbalancerede ligning ser vi, at 1 mol octan (C₈H₁₈) producerer 9 mol vand (H₂O).
3. Beregn molen af produceret vand:
* Brug molforholdet til at omdanne mol af oktan til mol vand:
0,468 mol c₈h₁₈ * (9 mol H₂O / 1 mol c₈h₁₈) = 4,212 mol H₂O
Derfor produceres 4,212 mol vand, når 0,468 mol octan brændes.
Sidste artikelHvad er fire typer af kimiske reaktioner?
Næste artikelHvor mange mol H2O er 7,038 gram H2O?
 Varme artikler
Varme artikler
-
 Neutroner undersøger iltgenererende enzym for en grønnere tilgang til rent vandKloritdismutase er et unikt oxygendannende enzym, der nedbryder chlorit, et industrielt forurenende stof, der findes globalt i grundvandet, drikkevand og jord. Forskning udført på ORNL bidrager til en
Neutroner undersøger iltgenererende enzym for en grønnere tilgang til rent vandKloritdismutase er et unikt oxygendannende enzym, der nedbryder chlorit, et industrielt forurenende stof, der findes globalt i grundvandet, drikkevand og jord. Forskning udført på ORNL bidrager til en -
 Hurtig overfladedynamik muliggjorde kold sammenføjning af metalliske glasTopvisninger af de tre metalliske glasbånd og de tilsvarende BMGer fremstillet ved ultralydsvibrationsmetoden. (Fotokreditter:Dr. J. Ma, Shenzhen Universitet). Kredit:Science Advances, doi:10.1126/sci
Hurtig overfladedynamik muliggjorde kold sammenføjning af metalliske glasTopvisninger af de tre metalliske glasbånd og de tilsvarende BMGer fremstillet ved ultralydsvibrationsmetoden. (Fotokreditter:Dr. J. Ma, Shenzhen Universitet). Kredit:Science Advances, doi:10.1126/sci -
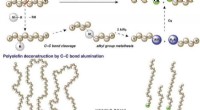 Plast kunne se et andet liv som biologisk nedbrydelige overfladeaktive stofferLange carbonhydridkæder af polymerer opdeles i kortere enheder med introduktionen af endegrupper af aluminium. Kredit:US Department of Energy, Ames Laboratorium Forskere ved Institute for Cooper
Plast kunne se et andet liv som biologisk nedbrydelige overfladeaktive stofferLange carbonhydridkæder af polymerer opdeles i kortere enheder med introduktionen af endegrupper af aluminium. Kredit:US Department of Energy, Ames Laboratorium Forskere ved Institute for Cooper -
 Halvledergennembrud kan være en game-changer for organiske solcellerEn organisk solcelletest inde i Randall Lab på Central Campus Ann Arbor, MI. Forskere fra University of Michigan har fundet en måde at lokke elektroner til at rejse meget længere, end man tidligere tr
Halvledergennembrud kan være en game-changer for organiske solcellerEn organisk solcelletest inde i Randall Lab på Central Campus Ann Arbor, MI. Forskere fra University of Michigan har fundet en måde at lokke elektroner til at rejse meget længere, end man tidligere tr
- Langsom som melasse? Sød men dødelig katastrofe fra 1919 forklaret
- Hvad er en teknologi, som oceanografer bruger i dag til at udforske Nhe Ocean Floor?
- Hvad er de tre hovedlag af havet?
- Hvad er klimaet i ørkener om sommeren?
- Designer biosensor kan påvise antibiotikaproduktion af mikrober
- Sexkromosomer (allosom): Definition, fakta og eksempler


