Hvad er grundlaget for en metallisk binding?
* metalatomer: Metalatomer har relativt få valenselektroner (elektroner i den yderste skal).
* Elektrondelokalisering: Disse valenselektroner er ikke tæt bundet til individuelle atomer. I stedet bliver de delokaliserede, hvilket betyder, at de kan bevæge sig frit gennem hele metalgitteret.
* Elektronhav: De delokaliserede elektroner danner et "hav", der omgiver de positivt ladede metalioner.
* Elektrostatisk attraktion: Tiltrækningen mellem de positivt ladede ioner og den negativt ladede elektronhav holder metallet sammen. Denne attraktion er den metalliske binding.
Nøgleegenskaber ved metalliske bindinger:
* stærk: Metalliske bindinger er generelt stærke, hvilket fører til høje smelte- og kogepunkter af metaller.
* ikke-retningsbestemt: Elektronhavet omgiver metalionerne i alle retninger, hvilket fører til ikke-retningsbestemt binding.
* duktil og formbar: De delokaliserede elektroner tillader metalatomer at glide forbi hinanden uden at bryde bindingen og give metaller deres duktilitet (evne til at blive trukket ind i ledninger) og formbarhed (evne til at blive hamret i ark).
* Gode elektriske ledere: De frit bevægende elektroner kan let bære elektrisk strøm, hvilket gør metaller fremragende ledere.
* gode termiske ledere: De delokaliserede elektroner kan også overføre varmeenergi effektivt, hvilket gør metaller gode termiske ledere.
Kortfattet: Den metalliske binding er en unik type binding, der opstår fra delokalisering af elektroner inden for et metalgitter. Denne delokalisering resulterer i en stærk, ikke-retningsbestemt binding, der forklarer de karakteristiske egenskaber ved metaller.
Sidste artikelEr lithium eller neon mere reaktiv?
Næste artikelHvad er den naturlige form for uran?
 Varme artikler
Varme artikler
-
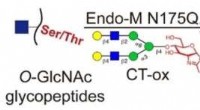 Reversibel kemoenzymatisk mærkningsstrategi muliggør dybdegående analyse af protein O-GlcNAcyleri…Kredit:Angewandte Chemie (2022). DOI:10.1002/ange.202117849 O-bundet β-N-acetylglucosamin (O-GlcNAcylation), en vigtig post-translationel modifikation (PTM) af proteiner, er involveret i forskellig
Reversibel kemoenzymatisk mærkningsstrategi muliggør dybdegående analyse af protein O-GlcNAcyleri…Kredit:Angewandte Chemie (2022). DOI:10.1002/ange.202117849 O-bundet β-N-acetylglucosamin (O-GlcNAcylation), en vigtig post-translationel modifikation (PTM) af proteiner, er involveret i forskellig -
 En ny nærhedsmærkningsmetode i nanometerskala målrettet histidinresterForskergruppen fandt en ny proteinkemisk mærkningsreaktion ved hjælp af singlet oxygen ( 1 O 2 ). Udnytter den korte diffusionsafstand på 1 O 2 og en teknik til at lokalisere 1 O 2 generat
En ny nærhedsmærkningsmetode i nanometerskala målrettet histidinresterForskergruppen fandt en ny proteinkemisk mærkningsreaktion ved hjælp af singlet oxygen ( 1 O 2 ). Udnytter den korte diffusionsafstand på 1 O 2 og en teknik til at lokalisere 1 O 2 generat -
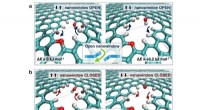 Nye mekanismer fundet til at adskille luftmolekylerFunktionel gruppeflappemekanisme i et lille nanowindow, som kan være i åben eller lukket status for at tillade O2 -gennemtrængning. Kredit:2018, Naturkommunikation , Licenseret under CC BY 4.0 N
Nye mekanismer fundet til at adskille luftmolekylerFunktionel gruppeflappemekanisme i et lille nanowindow, som kan være i åben eller lukket status for at tillade O2 -gennemtrængning. Kredit:2018, Naturkommunikation , Licenseret under CC BY 4.0 N -
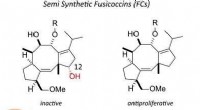 Redigeret plantebaseret toksin besidder antitumoregenskaberFusicoccin, et fytotoksin, blev omdannet til en række antiproliferative midler til tumorceller ved at fjerne 12-hydroxylgruppen. Disse forbindelser blev vist at opregulere interaktion mellem 1433 og e
Redigeret plantebaseret toksin besidder antitumoregenskaberFusicoccin, et fytotoksin, blev omdannet til en række antiproliferative midler til tumorceller ved at fjerne 12-hydroxylgruppen. Disse forbindelser blev vist at opregulere interaktion mellem 1433 og e
- Hvordan kan hastighed måles i en bil?
- Ingeniører bruger kunstig intelligens til at skændes om fusionskraft til nettet
- Er en videnskabsmand for dine spørgsmål?
- DNA:Byggesten til mindre, smartere elektronik?
- Hvordan nye beviser for kønsvendinger hjælper med at vise, hvordan kromosomer opretholdes over evo…
- Når du flytter din arm til at bruge computermus, hvilken af disse muskelcelletyper er der involve…


