Hvad sker der, når to ædle gasser kombineres?
Her er hvorfor:
* Fuld valensskaller: Noble gasser har en fuld ydre skal af elektroner (8 elektroner, bortset fra helium, der har 2). Dette gør dem meget stabile og ureaktive.
* svage intermolekylære kræfter: De eneste kræfter, der holder ædle gasatomer sammen, er svage van der Waals -styrker. Disse kræfter er ikke stærke nok til at skabe kemiske bindinger.
Derfor, når to ædle gasser kombineres, danner de simpelthen en blanding, ikke en forbindelse. For eksempel ville en blanding af helium og neon bare være en gas, der indeholder begge gasser.
Der er dog nogle få undtagelser:
* under ekstreme forhold: Ved meget høje tryk eller lave temperaturer kan nogle ædle gasser danne forbindelser med andre elementer, såsom Xenon Hexafluorid (XEF 6 ).
* van der Waals interaktioner: Selvom de ikke danner bindinger, kan ædle gasser interagere med hinanden gennem svage van der Waals -styrker. Disse interaktioner kan påvirke deres fysiske egenskaber, såsom kogepunkt.
Kortfattet: Kombination af ædelgasser resulterer typisk i en simpel blanding uden kemisk binding. Mens der er nogle undtagelser under ekstreme forhold, forbliver ædle gasser generelt inerte og ureaktive.
Sidste artikelHvad er den mest almindelige forbindelse, der findes i din krop?
Næste artikelHvad er syntetisk fremstillede kemiske stoffer?
 Varme artikler
Varme artikler
-
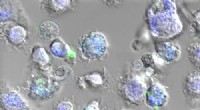 En ny slags vaccine baseret på edderkoppesilkeImmunceller, der indtog nanopartikler af edderkoppesilke (i grønt). Endosomerne - den del af cellen, hvori nanopartiklerne frigiver vaccinen - vises i blåt. Kredit:Laboratoire Bourquin – UNIGE For
En ny slags vaccine baseret på edderkoppesilkeImmunceller, der indtog nanopartikler af edderkoppesilke (i grønt). Endosomerne - den del af cellen, hvori nanopartiklerne frigiver vaccinen - vises i blåt. Kredit:Laboratoire Bourquin – UNIGE For -
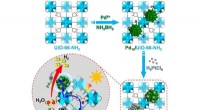 Enkeltatomlegering:Fremragende cokatalysator til fotokatalyseOverfladeladningstilstanden af co-katalysator spiller en vigtig rolle i fotokatalyse. Imidlertid, forordningen om overfladeladningstilstand for co-katalysatorer, især ved at ændre deres mikrostruktu
Enkeltatomlegering:Fremragende cokatalysator til fotokatalyseOverfladeladningstilstanden af co-katalysator spiller en vigtig rolle i fotokatalyse. Imidlertid, forordningen om overfladeladningstilstand for co-katalysatorer, især ved at ændre deres mikrostruktu -
 Antibiotisk indsigt kan hjælpe i kampen mod bakteriel resistensLektor Max Cryle. Kredit:Monash University Bakterier eller superbugs, der har tilpasset sig til at modstå flere antibiotika, er ansvarlige for omkring 700, 000 dødsfald globalt om året; nye typer
Antibiotisk indsigt kan hjælpe i kampen mod bakteriel resistensLektor Max Cryle. Kredit:Monash University Bakterier eller superbugs, der har tilpasset sig til at modstå flere antibiotika, er ansvarlige for omkring 700, 000 dødsfald globalt om året; nye typer -
 Oprettelse af en 3D-trykt bioresorberbar luftvejsstentKredit:Pixabay/CC0 Public Domain Indsnævring af luftrøret eller hovedbronkierne på grund af skade eller sygdom kan ende meget dårligt. Hvis patienter får for lidt luft, ilt, de risikerer at blive
Oprettelse af en 3D-trykt bioresorberbar luftvejsstentKredit:Pixabay/CC0 Public Domain Indsnævring af luftrøret eller hovedbronkierne på grund af skade eller sygdom kan ende meget dårligt. Hvis patienter får for lidt luft, ilt, de risikerer at blive


