Molekyler, der har en ulig fordeling af ladninger?
Her er hvorfor:
* Polaritet: Polaritet henviser til adskillelse af elektrisk ladning inden for et molekyle. Denne adskillelse skaber en positiv og en negativ ende, der ligner polerne i en magnet.
* ulig deling af elektroner: Polære molekyler stammer fra den ulige deling af elektroner mellem atomer i en kovalent binding. Denne ulige deling opstår, når det ene atom har en højere elektronegativitet end den anden. Elektronegativitet er et atoms evne til at tiltrække elektroner.
Eksempler på polære molekyler:
* vand (H₂O): Oxygen er mere elektronegativt end brint, så elektronerne i O-H-bindingerne bruger mere tid i nærheden af iltatomet, hvilket giver det en delvis negativ ladning (Δ-) og hydrogenatomerne en delvis positiv ladning (Δ+).
* ammoniak (NH₃): Nitrogen er mere elektronegativ end brint, hvilket resulterer i en delvis negativ ladning på nitrogenatomet og delvis positive ladninger på brintatomerne.
* hydrogenchlorid (HCL): Klor er meget mere elektronegativ end brint, hvilket skaber et betydeligt dipolmoment.
Nøgleegenskaber for polære molekyler:
* opløselighed: Polære molekyler har en tendens til at opløses i andre polære opløsningsmidler som vand. Dette skyldes, at de positive og negative ender af molekylerne kan interagere gennem elektrostatiske kræfter.
* høje kogepunkter: Tiltrækningen mellem polære molekyler er stærkere end tiltrækningen mellem ikke -polære molekyler, hvilket fører til højere kogepunkter.
* gode ledere af elektricitet: Når polære molekyler opløses i vand, kan de udføre elektricitet, fordi de ladede ender af molekylerne kan bevæge sig og bære ladning.
Fortæl mig, hvis du gerne vil have flere eksempler eller forklaringer!
Sidste artikelEr hydrofluorsyre et halogeneret opløsningsmiddel?
Næste artikelHvad er universelt opløsningsmiddel i et vandmolekyle?
 Varme artikler
Varme artikler
-
 Forskere får et atomistisk billede af platinkatalysatornedbrydningRøntgendiffraktionsopsætning ved ID31-strålelinje, European Synchrotron Radiation Facility. Kredit:Natalie Stubb Nedbrydning af platin, bruges som et nøgleelektrodemateriale i brintøkonomien, fork
Forskere får et atomistisk billede af platinkatalysatornedbrydningRøntgendiffraktionsopsætning ved ID31-strålelinje, European Synchrotron Radiation Facility. Kredit:Natalie Stubb Nedbrydning af platin, bruges som et nøgleelektrodemateriale i brintøkonomien, fork -
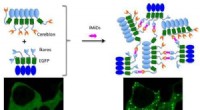 Se små molekylers interaktioner inde i cellerKredit:American Chemical Society Som mennesker i en stor virksomhed, proteiner i celler interagerer konstant med hinanden for at udføre forskellige job. At udvikle nye sygdomsbehandlinger, forsker
Se små molekylers interaktioner inde i cellerKredit:American Chemical Society Som mennesker i en stor virksomhed, proteiner i celler interagerer konstant med hinanden for at udføre forskellige job. At udvikle nye sygdomsbehandlinger, forsker -
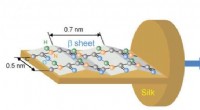 Ny infrarød billeddannelsesteknik afslører molekylær orientering af proteiner i silkefibreOrienteringen af C =O, C-N, og NH-bindinger i amidstruktur af L-sektionen af silkefibre bekræftet i denne undersøgelse af hyper-spektral billeddannelse. Kredit:Australian Synchrotron Et stort
Ny infrarød billeddannelsesteknik afslører molekylær orientering af proteiner i silkefibreOrienteringen af C =O, C-N, og NH-bindinger i amidstruktur af L-sektionen af silkefibre bekræftet i denne undersøgelse af hyper-spektral billeddannelse. Kredit:Australian Synchrotron Et stort -
 Undersøgelse afslører ny indsigt i, hvordan hybride perovskit-solceller fungererDenne illustration viser, hvad der sker inde i et hybridt perovskitmateriale i de første par billiontedele af et sekund, efter at det er ramt af simuleret sollys (øverst til venstre). De blå og grønne
Undersøgelse afslører ny indsigt i, hvordan hybride perovskit-solceller fungererDenne illustration viser, hvad der sker inde i et hybridt perovskitmateriale i de første par billiontedele af et sekund, efter at det er ramt af simuleret sollys (øverst til venstre). De blå og grønne


