Hvad sker der, da et solidt begynder at ændre væske?
1. Øget molekylær bevægelse:
* Molekylerne i et fast stof er tæt pakket og vibrerer i faste positioner. Efterhånden som der tilføjes varme, bliver disse vibrationer mere energiske.
* Ved en bestemt temperatur (smeltepunktet) bliver vibrationerne så stærke, at molekylerne overvinder de attraktive kræfter, der holder dem i deres faste positioner.
2. Svækkelse af intermolekylære kræfter:
* Varmeenergien forstyrrer de stærke intermolekylære kræfter (som brintbindinger, dipol-dipolinteraktioner eller London-spredningskræfter), der holder molekylerne sammen i en fast gitter.
* Denne svækkelse giver molekylerne mulighed for at bevæge sig mere frit og ændre deres positioner.
3. Ændring i struktur:
* Den stive, krystallinske struktur af de faste nedbrud. Molekylerne begynder at bevæge sig forbi hinanden og påtage sig et mindre organiseret, mere flydende arrangement.
4. Øget entropi:
* Overgangen fra fast stof til væske øger systemets lidelse og tilfældighed, der er kendt som entropi.
5. Volumenændring:
* Afhængigt af stoffet kan volumen enten øges eller falde under smeltning. F.eks. Udvides vand, når det fryser, men de fleste stoffer samles på smeltning.
6. Faseændring:
* Overgangen fra fast stof til væske er en faseændring, hvilket betyder en ændring i sagens fysiske tilstand. Denne ændring ledsages normalt af en ændring i densitet, viskositet og andre fysiske egenskaber.
I det væsentlige involverer smeltning:
* Få energi: Varme absorberes af det faste stof, hvilket øger molekylernes kinetiske energi.
* overvinde kræfter: Den tilsatte energi svækker kræfterne, der holder molekylerne sammen i en fast struktur.
* skift til en mere forstyrret tilstand: Molekylerne bliver mere mobile og mindre organiserede, hvilket resulterer i en væske.
Sidste artikelNår et stof udvider det, der sker med dets masse?
Næste artikelEr pH 9 i vaskeri flydende god?
 Varme artikler
Varme artikler
-
 Et elektrisk ladet glasdisplay skifter jævnt mellem et spektrum af farverKredit:Pixabay/CC0 Public Domain Forskere har udviklet en gennemsigtig glasskærm med et højt hvidt lyskontrastforhold, der jævnt skifter mellem et bredt spektrum af farver, når det er elektrisk la
Et elektrisk ladet glasdisplay skifter jævnt mellem et spektrum af farverKredit:Pixabay/CC0 Public Domain Forskere har udviklet en gennemsigtig glasskærm med et højt hvidt lyskontrastforhold, der jævnt skifter mellem et bredt spektrum af farver, når det er elektrisk la -
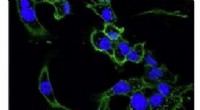 Polymer afledt af materiale i rejeskaller kunne levere anti-cancermedicin til tumorstederDisse billeder viser brystkræftceller fra mus taget under et mikroskop. På begge billeder grøn angiver cellemembranen, og blå angiver kernen. Celler i det nederste billede er blevet behandlet med Taxo
Polymer afledt af materiale i rejeskaller kunne levere anti-cancermedicin til tumorstederDisse billeder viser brystkræftceller fra mus taget under et mikroskop. På begge billeder grøn angiver cellemembranen, og blå angiver kernen. Celler i det nederste billede er blevet behandlet med Taxo -
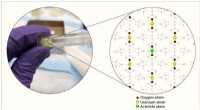 Undersøgelse afslører et-trins strategi for genanvendelse af brugt nukleart brændselEt-trins kemisk reaktion foreskrevet i undersøgelsen fører til dannelsen af krystaller, der indeholder uran (gulfyldte cirkler) og små mængder af andre resterende brændstofelementer (grønfyldte cirk
Undersøgelse afslører et-trins strategi for genanvendelse af brugt nukleart brændselEt-trins kemisk reaktion foreskrevet i undersøgelsen fører til dannelsen af krystaller, der indeholder uran (gulfyldte cirkler) og små mængder af andre resterende brændstofelementer (grønfyldte cirk -
 Video:Hvad er kemien bag ringorm?Vidste du, at ringorm faktisk ikke er en orm? Denne uge om reaktioner, find ud af hvad ringorm er; hvordan den skyldige lever af din hud, hår og negle; og hvordan man ikke bliver det næste måltid:
Video:Hvad er kemien bag ringorm?Vidste du, at ringorm faktisk ikke er en orm? Denne uge om reaktioner, find ud af hvad ringorm er; hvordan den skyldige lever af din hud, hår og negle; og hvordan man ikke bliver det næste måltid:
- Føler din sol og enhver stjerne langt væk i en anden galakse, selvom de er meget adskilt, stadig e…
- Sådan bruges Trigonometri i Engineering
- Regulering af den indirekte arealanvendelse af kulstofemissioner fra biobrændstoffer påfører bræ…
- Edderkoppesilke kan skabe linser, der er nyttige til biologisk billeddannelse
- Hvad er tætheden af et æg?
- Australsk parlamentarisk netværk hacket; ingen tegndata stjålet


