Er isotoper med samme element egenskaber?
Her er hvorfor:
* Lignende kemiske egenskaber: Isotoper har det samme antal protoner og elektroner, der bestemmer et elements kemiske opførsel. Dette betyder, at de reagerer på lignende måde med andre elementer og danner lignende forbindelser.
* forskellige fysiske egenskaber: Isotoper adskiller sig i antallet af neutroner, hvilket påvirker deres masse og hvordan de interagerer med stråling. Dette kan føre til forskelle i:
* Masse: Tyngre isotoper vil have en højere atommasse.
* densitet: Densitet er relateret til masse, så tungere isotoper vil være lidt tættere.
* smelte- og kogepunkter: Disse kan være lidt forskellige på grund af forskelle i intermolekylære kræfter forårsaget af massevariationen.
* Radioaktivitet: Nogle isotoper er radioaktive, mens andre er stabile. Denne forskel opstår på grund af det ustabile neutron-til-proton-forhold i radioaktive isotoper.
Eksempel:
Carbon-12 og carbon-14 er isotoper af kulstof. De har begge 6 protoner og 6 elektroner, hvilket gør dem kemisk identiske. Carbon-12 har imidlertid 6 neutroner, mens carbon-14 har 8 neutroner. Denne forskel i neutronantal gør carbon-14 radioaktiv og lidt tungere end carbon-12.
Kortfattet: Isotoper deler den samme kemiske opførsel, men kan udvise forskellige fysiske egenskaber, især med hensyn til masse, densitet og radioaktivitet.
Sidste artikelHar alle faste stoffer lignende egenskaber?
Næste artikelHvad er nogle egenskaber ved deuterium?
 Varme artikler
Varme artikler
-
 Konstruerede mikrober kan producere bionedbrydeligt plast til lavere omkostninger og miljøpåvirkni…Langt størstedelen af plastik er lavet af fossile brændstoffer, og nedbrydes ikke biologisk. Plastforurening hober sig op i vores have og vandveje, og mikroplast kommer i jorden, dyr, og endda vores
Konstruerede mikrober kan producere bionedbrydeligt plast til lavere omkostninger og miljøpåvirkni…Langt størstedelen af plastik er lavet af fossile brændstoffer, og nedbrydes ikke biologisk. Plastforurening hober sig op i vores have og vandveje, og mikroplast kommer i jorden, dyr, og endda vores -
 Udvidelse af omfanget af epoxidringåbningsreaktioner med zirconocenForskere demonstrerer for første gang en epoxid-ringåbningsreaktion katalyseret af zirconocen under synligt lys. Kredit:Waseda University Epoxider tilhører en klasse af organiske forbindelser kalde
Udvidelse af omfanget af epoxidringåbningsreaktioner med zirconocenForskere demonstrerer for første gang en epoxid-ringåbningsreaktion katalyseret af zirconocen under synligt lys. Kredit:Waseda University Epoxider tilhører en klasse af organiske forbindelser kalde -
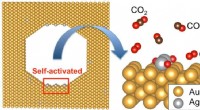 Håber på nye katalysatorer med høj aktivitetFigur:En aktiv struktur i en nanoporøs guldkatalysator. Kredit:Osaka University Guld er et metal, der er kemisk inaktivt og ikke korroderer, men nanoporøst guld (NPG), med dens svampelignende stru
Håber på nye katalysatorer med høj aktivitetFigur:En aktiv struktur i en nanoporøs guldkatalysator. Kredit:Osaka University Guld er et metal, der er kemisk inaktivt og ikke korroderer, men nanoporøst guld (NPG), med dens svampelignende stru -
 Med molekylær datalagring, kattevideoer kan overleve os alleBrian Cafferty, en postdoktor i laboratoriet hos George Whitesides, medforfatter til et papir om nye fremskridt inden for molekylær lagring. Kredit:Kris Snibbe/Harvard Staff Photographer Fra bøger
Med molekylær datalagring, kattevideoer kan overleve os alleBrian Cafferty, en postdoktor i laboratoriet hos George Whitesides, medforfatter til et papir om nye fremskridt inden for molekylær lagring. Kredit:Kris Snibbe/Harvard Staff Photographer Fra bøger


