Hvorfor ædle gas viser variabel oxidationstilstand?
* Fuld valensskaller: Noble gasser har en komplet oktet af elektroner i deres yderste skal (undtagen helium, der har en fuld duet). Denne stabile elektronkonfiguration gør dem ekstremt ureaktive og resistente over for at vinde eller miste elektroner.
* Høj ioniseringsenergier: Noble gasser har høje ioniseringsenergier, hvilket betyder, at det kræver en masse energi for at fjerne et elektron fra deres atomer. Dette bidrager yderligere til deres inerte natur.
Undtagelser:
Mens de fleste ædle gasser er inerte, er et par tungere ( xenon , krypton og radon ) kan danne forbindelser med stærkt elektronegative elementer som fluor og ilt. Disse forbindelser udviser variable oxidationstilstande, som tilskrives:
* relativistiske effekter: I tungere ædle gasser bevæger elektronerne i deres ydre skaller med en betydelig brøkdel af lysets hastighed. Dette fører til relativistiske effekter, der reducerer den effektive atomafgift og gør de yderste elektroner lettere fjernet.
* høj fluorreaktivitet: Fluor, der er det mest elektronegative element, kan overvinde stabiliteten af den ædle gaselektronkonfiguration og tvinge den til at dele elektroner, hvilket resulterer i sammensat dannelse.
Eksempler på variable oxidationstilstande:
* xenon: I XEF₂ (Xenon difluorid) har Xenon en oxidationstilstand på +2. I Xeo₄ (Xenon -tetroxid) har Xenon en oxidationstilstand på +8.
* krypton: Krypton kan danne krf₂ (krypton difluorid), hvor det har en oxidationstilstand på +2.
* radon: Radon kan danne RNF₂ (radon difluorid), hvor det har en oxidationstilstand på +2.
Det er vigtigt at huske, at disse undtagelser er relativt sjældne. Ædle gasser anses generelt for at have faste oxidationstilstande på 0, hvilket afspejler deres inerte natur.
Sidste artikelHvad har kalium og Krypton til fælles?
Næste artikelHvad danner NH3?
 Varme artikler
Varme artikler
-
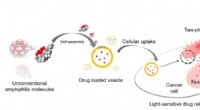 Ny teknologi til levering af kræft mod kræftOversigt over forsøget. Hule græskarformede molekyler med allyloxyhaler samler sig selv i vesikler, som kan transportere lægemidler ind i kræftceller. Derefter bryder en laser vesiklerne, hvilket lett
Ny teknologi til levering af kræft mod kræftOversigt over forsøget. Hule græskarformede molekyler med allyloxyhaler samler sig selv i vesikler, som kan transportere lægemidler ind i kræftceller. Derefter bryder en laser vesiklerne, hvilket lett -
 Brug af industriaffald som isolering til bygningerDe fire unge iværksættere bag FenX kender hinanden fra deres tid på Institut for Materialer på ETH Zürich. Kredit:ETH Zürich / Andres Eberhardt ETH-spinoff FenX omdanner industriaffald til et porø
Brug af industriaffald som isolering til bygningerDe fire unge iværksættere bag FenX kender hinanden fra deres tid på Institut for Materialer på ETH Zürich. Kredit:ETH Zürich / Andres Eberhardt ETH-spinoff FenX omdanner industriaffald til et porø -
 Ny tilgang gør det letteste bilmetal mere økonomisk, nyttigEt rør med en diameter på 50 mm med en vægtykkelse på 1,5 mm skabt af en solid luns magnesiumlegering ved hjælp af PNNLs ShAPE™-ekstruderingsproces. Kredit:PNNL Magnesium - det letteste af alle st
Ny tilgang gør det letteste bilmetal mere økonomisk, nyttigEt rør med en diameter på 50 mm med en vægtykkelse på 1,5 mm skabt af en solid luns magnesiumlegering ved hjælp af PNNLs ShAPE™-ekstruderingsproces. Kredit:PNNL Magnesium - det letteste af alle st -
 Kryo-elektronmikroskopi kaster nyt lys over batterierKredit:Kourkoutis Lab Grænsefladen mellem den faste anode og den flydende elektrolyt spiller en afgørende rolle i ydelsen af et lithium-metalbatteri, men karakterisering af de processer, der ske
Kryo-elektronmikroskopi kaster nyt lys over batterierKredit:Kourkoutis Lab Grænsefladen mellem den faste anode og den flydende elektrolyt spiller en afgørende rolle i ydelsen af et lithium-metalbatteri, men karakterisering af de processer, der ske
- Store forhåbninger til australske forsøg på at opdrætte pandaunger
- Undersøgelse skinner lys over alternative medicinske billeddannelsesteknikker
- Super-Jordens exoplanet i kredsløb om nærliggende stjerne opdaget
- Sådan fungerer balsamering
- Når fase og neutral vil kort betyder, hvad er spændingen i neutral?
- Problemer med sputter? Skyld skylden på gigantiske nanopartikler


