Hvad har kalium og Krypton til fælles?
* placering på den periodiske tabel: Kalium (K) er et alkalimetal, der findes i gruppe 1. Krypton (KR) er en ædel gas, der findes i gruppe 18.
* Kemisk reaktivitet: Kalium er meget reaktiv og mister let et elektron for at danne en positiv ion. Krypton er meget ureaktiv og eksisterer som et enkelt atom og danner ikke let forbindelser.
* tilstand ved stuetemperatur: Kalium er et fast metal ved stuetemperatur. Krypton er en farveløs, lugtfri gas.
* anvendelser: Kalium har mange anvendelser, herunder gødning, batterier og sprængstoffer. Krypton bruges i lasere og belysning.
Den eneste virkelige lighed er, at de begge er elementer. De er meget forskellige i deres kemiske og fysiske egenskaber.
Sidste artikelHvilke uorganiske molekyler udgør glukose?
Næste artikelHvorfor ædle gas viser variabel oxidationstilstand?
 Varme artikler
Varme artikler
-
 SLACs højhastighedselektronkamera filmer molekylær film i HDForskere skabte den første film med atomopløsning af ringåbningsreaktionen af 1, 3-cyclohexadien (CHD) med et elektronkamera kaldet UED. Nederst:UED-elektronstrålen måler nøjagtigt afstandene mellem
SLACs højhastighedselektronkamera filmer molekylær film i HDForskere skabte den første film med atomopløsning af ringåbningsreaktionen af 1, 3-cyclohexadien (CHD) med et elektronkamera kaldet UED. Nederst:UED-elektronstrålen måler nøjagtigt afstandene mellem -
 Multifunktionelle drømkeramiske matrixkompositter fødes(Øverst til venstre) Dette er en struktur af Ti-spredt AI 2 O 3 kompositter (nederst til venstre) Ti -indhold afhængighed af brud ruhed og elektrisk resistivitet (midten) Nanostruktur af overflade
Multifunktionelle drømkeramiske matrixkompositter fødes(Øverst til venstre) Dette er en struktur af Ti-spredt AI 2 O 3 kompositter (nederst til venstre) Ti -indhold afhængighed af brud ruhed og elektrisk resistivitet (midten) Nanostruktur af overflade -
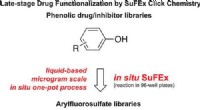 Klikkemi-reaktioner kan øge kræftbekæmpende lægemiddelstyrkeKredit:ACS Forskere ved The Scripps Research Institute (TSRI) har udviklet en hurtig og nem måde til samtidig at modificere snesevis af lægemidler eller molekyler for at forbedre deres sygdomsbekæ
Klikkemi-reaktioner kan øge kræftbekæmpende lægemiddelstyrkeKredit:ACS Forskere ved The Scripps Research Institute (TSRI) har udviklet en hurtig og nem måde til samtidig at modificere snesevis af lægemidler eller molekyler for at forbedre deres sygdomsbekæ -
 Forbedring af genleveringsmetoderKredit:Royal Society of Chemistry Forskere i Kina undersøger nye måder at behandle kræft på ved hjælp af genterapi. Vi finder ud af, hvordan deres arbejde inspirerede dette smukke og indviklede de
Forbedring af genleveringsmetoderKredit:Royal Society of Chemistry Forskere i Kina undersøger nye måder at behandle kræft på ved hjælp af genterapi. Vi finder ud af, hvordan deres arbejde inspirerede dette smukke og indviklede de
- Lys fra sjældne jordarter:Nye muligheder for organiske lysdioder
- Hvad observerer videnskabsmand mest?
- Dårlig luft og utilstrækkelige data viser en usund blanding
- Hvilke kræfter forårsager mekanisk forvitring?
- En ny tidslinje for Jordens katastrofale fortid
- Mod et mere realistisk billede af, hvordan molekyler bevæger sig i celler


