Hvad er nogle kemiske reaktioner, der forekommer uden for hjemmet?
Naturlige processer:
* Fotosyntese: Planter bruger sollys, vand og kuldioxid til at producere glukose (sukker) og ilt. Dette sker i blade og andre grønne dele af planter.
* respiration: Dyr og planter indånder ilt og bruger det til at nedbryde glukose, frigive energi og producere kuldioxid og vand. Dette er det modsatte af fotosyntesen.
* forbrænding: Brændende brændstoffer som træ, gas eller olie involverer en hurtig reaktion med ilt til at frigive energi som varme og lys. Dette driver biler, kraftværker og mange andre ting.
* Rusting: Jern reagerer med ilt og vand for at danne jernoxid, almindeligt kendt som rust. Dette er en langsom proces, men fører til forringelse af metalstrukturer.
* Vejring: Klipper og mineraler nedbrydes over tid på grund af reaktioner med vand, luft og andre stoffer. Dette skaber jord og ændrer landskabet.
Industrielle processer:
* Fremstilling: Mange industrielle processer er afhængige af kemiske reaktioner for at skabe nye produkter. Eksempler inkluderer at fremstille plast, gødning, farmaceutiske produkter og utallige andre materialer.
* olieraffinering: Råolie behandles gennem forskellige kemiske reaktioner for at adskille den i benzin, diesel, parafin og andre nyttige produkter.
* metalproduktion: Metaller som jern og aluminium ekstraheres fra malm gennem kemiske reaktioner.
* spildevandsbehandling: Kemiske reaktioner bruges til at rense spildevand, fjerne forurenende stoffer og gøre det sikkert at frigive tilbage i miljøet.
Andre eksempler:
* sur regn: Svovldioxid og nitrogenoxider fra forbrænding af fossile brændstoffer reagerer med vand i atmosfæren for at danne svovlsyre og salpetersyre, der falder til jorden som surt regn.
* ozonudtømning: Chlorofluorcarbons (CFC'er) frigivet fra kølemidler og andre produkter reagerer med ozon i stratosfæren og ødelægger ozonlaget, der beskytter os mod skadelig ultraviolet stråling.
* nukleare reaktioner: Atomkraftværker bruger kontrollerede nukleare reaktioner til at generere elektricitet. Disse involverer opdeling af atomer og frigiver enorme mængder energi.
Dette er kun et par eksempler på de mange kemiske reaktioner, der sker uden for hjemmet. Verden omkring os ændrer sig konstant gennem kemiske processer, former miljøet, driver industrien og påvirker vores liv.
Sidste artikelHvad har den største elektronegativitet se s cl?
Næste artikelHvor mange valens har elektroner gallium?
 Varme artikler
Varme artikler
-
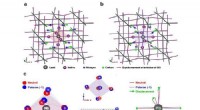 Skinner lys over spændingstilstande i perovskitmaterialerTeoretisk forudsagte strukturer af MAPbI 3 hybrid perovskit:en neutral klynge. b negativt ladet (polaron) klynge. c Forskellige perspektivlige sammenligninger af den neutrale (røde sfære) og polaron
Skinner lys over spændingstilstande i perovskitmaterialerTeoretisk forudsagte strukturer af MAPbI 3 hybrid perovskit:en neutral klynge. b negativt ladet (polaron) klynge. c Forskellige perspektivlige sammenligninger af den neutrale (røde sfære) og polaron -
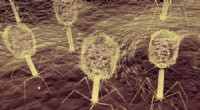 Viruss mangestrengede angreb på bakterier peger på nye måder at bekæmpe infektion påFager angriber en bakterie. Kredit:Imperial College London Forskere har afdækket, hvordan en virus anvender et todelt angreb mod et enkelt protein for at dræbe bakterier. Den internationale grupp
Viruss mangestrengede angreb på bakterier peger på nye måder at bekæmpe infektion påFager angriber en bakterie. Kredit:Imperial College London Forskere har afdækket, hvordan en virus anvender et todelt angreb mod et enkelt protein for at dræbe bakterier. Den internationale grupp -
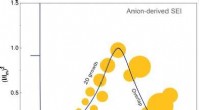 Anioner og opløsningsmidler styrer kernedannelse og vækst af den faste elektrolyt-interfase© Wiley-VCH. Kredit:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494 Batterier oplades og genoplades - tilsyneladende alt sammen takket være et perfekt samspil mellem elektro
Anioner og opløsningsmidler styrer kernedannelse og vækst af den faste elektrolyt-interfase© Wiley-VCH. Kredit:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494 Batterier oplades og genoplades - tilsyneladende alt sammen takket være et perfekt samspil mellem elektro -
 Hvorfor er visse tungmetaller okay at spise? (video)Kredit:The American Chemical Society Tungmetaller har ry for at være farlige, men nogle er essentielle næringsstoffer, som du ikke kan leve uden. I denne uges afsnit af Reaktioner , undersøger vi h
Hvorfor er visse tungmetaller okay at spise? (video)Kredit:The American Chemical Society Tungmetaller har ry for at være farlige, men nogle er essentielle næringsstoffer, som du ikke kan leve uden. I denne uges afsnit af Reaktioner , undersøger vi h
- Hvorfor er lithium og beryllium kovalente i naturen?
- Hvordan påvirker vejret os?
- Hvordan adskiller man pulver fra vand?
- Hurtig varme strømmer i varme, tæt aluminium
- Hydrogenbromidpartikler er omkring dobbelt så tunge hydrogenchlorid. hvilken effekt tror du ville h…
- Zig-zagging-enhed fokuserer på højenergi-strålingsemissioner


