Anioner og opløsningsmidler styrer kernedannelse og vækst af den faste elektrolyt-interfase
© Wiley-VCH. Kredit:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494
Batterier oplades og genoplades - tilsyneladende alt sammen takket være et perfekt samspil mellem elektrodemateriale og elektrolyt. Imidlertid, for ideel batterifunktion, den faste elektrolyt-interfase (SEI) spiller en afgørende rolle. Materialeforskere har nu studeret nukleation og vækst af dette lag i atomare detaljer. Ifølge undersøgelsen offentliggjort i tidsskriftet Angewandte Chemie , egenskaberne af anioner og opløsningsmiddelmolekyler skal være velafbalancerede.
I lithium-ion-batterier, SEI-formularerne i begyndelsen af den første opladningsproces, når et potentiale anvendes. Elementer fra elektrolytten aflejres på grafitelektroden og danner en belægning, der snart dækker hele elektroden. Først efter at dette lag er afsluttet, kan de positive lithium-ioner interkalere i elektroden uden at eksfoliere elektrodematerialet.
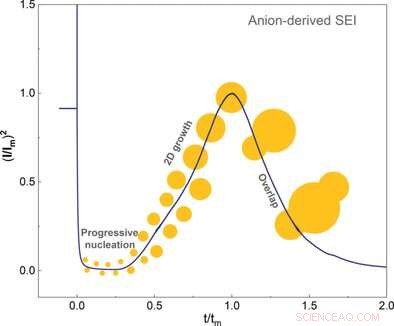
Qiang Zhang og kolleger ved Tsinghua University, Beijing, Kina, har nu set nærmere på kernedannelsen og væksten af SEI. Elektrolytten i lithium-ion-batterier indeholder lithiumsalt og et opløsningsmiddel. Stærkt opløselige opløsningsmidler omslutter lithiumionen, og anionerne flyder frit. I modsætning, svagt solvaterende elektrolytter muliggør en tættere binding af anionerne til lithium-ionen. Her, anionerne forbliver en del af den indre solvatiseringsskal.
Denne indre solvatiseringsskal skal fjernes fra lithiumet for at tillade SEI-dannelse og vækst. Forskerne viste, at anionerne i den indre skal først adsorberede ved den friske elektrode og derefter optog to elektroner i en elektrokemisk reaktion. Denne sidstnævnte begivenhed udløste nedbrydning og kernedannelse af SEI. Forfatterne konkluderede, at SEI-dannelse hovedsageligt afhang af, hvor let anionerne kan fange elektroner og nedbrydes sammenlignet med opløsningsmidlet.
Forskerne brugte elektrokemiske teknikker og atomkraftmikroskopi til at undersøge krystalvæksten indtil lagets afslutning. De fandt ud af, at der kun dannedes et glat lag ved lave overpotentialer. Opløsningsmidlet påvirkede også overpotentialet. Forfatterne bemærkede også, at opløsningsmidler med høj affinitet til det krystallinske lag overhovedet ikke gav noget overpotentiale.
De konkluderede, at fremtidige designs af højtydende elektroder burde fokusere mere på samspillet mellem de negative ioner af lithiumsaltet og opløsningsmidlet. For at tillade en homogen uorganisk, krystallinsk SEI, der skal dannes, anionerne skulle udkonkurrere opløsningsmidlet; de skulle lettere adsorbere til elektrodeoverfladen og foretage elektrokemiske reaktioner. Ud over, nedbrydningsprodukterne skal være faste og uopløselige, men stadig vise en vis affinitet til opløsningsmidlet, sagde forfatterne.
 Varme artikler
Varme artikler
-
 Spædningseffekt forårsaget af rodstrøelse varierer med rodrækkefølgenGrafisk abstrakt. Kredit:DOI:10.1016/j.soilbio.2021.108354 Planteaffald kan påvirke jordens organiske kulstofdynamik via priming-effekten, som defineres som ændringer i jordens organiske kulstofne
Spædningseffekt forårsaget af rodstrøelse varierer med rodrækkefølgenGrafisk abstrakt. Kredit:DOI:10.1016/j.soilbio.2021.108354 Planteaffald kan påvirke jordens organiske kulstofdynamik via priming-effekten, som defineres som ændringer i jordens organiske kulstofne -
 Sætter scenen for brændstofeffektiv gødningKredit:ACS Ammoniak, den primære ingrediens i nitrogenbaserede gødninger, har hjulpet med at brødføde verden siden 1. Verdenskrig. Men at lave ammoniak i industriel skala kræver meget energi, og d
Sætter scenen for brændstofeffektiv gødningKredit:ACS Ammoniak, den primære ingrediens i nitrogenbaserede gødninger, har hjulpet med at brødføde verden siden 1. Verdenskrig. Men at lave ammoniak i industriel skala kræver meget energi, og d -
 Kan udetemperaturen påvirke central AC?Når temperaturerne begynder at klatre, har underdimensionerede eller ældre, mindre effektive klimaanlæg enhed med problemer med at køle indersiden af luften. Klimaanlægscyklussen involverer cirkulat
Kan udetemperaturen påvirke central AC?Når temperaturerne begynder at klatre, har underdimensionerede eller ældre, mindre effektive klimaanlæg enhed med problemer med at køle indersiden af luften. Klimaanlægscyklussen involverer cirkulat -
 Molekyle, der virker på menneskelige celler, kan give håb om uimodståelig kuldekurDet nye molekyle IMP-1088 (gul) blokerer human NMT (blå), et protein, der er essentielt for forkølelsesvirus til at samle den geometriske kapsid-skal, som omslutter dets RNA-genom (grøn). Kredit:Imper
Molekyle, der virker på menneskelige celler, kan give håb om uimodståelig kuldekurDet nye molekyle IMP-1088 (gul) blokerer human NMT (blå), et protein, der er essentielt for forkølelsesvirus til at samle den geometriske kapsid-skal, som omslutter dets RNA-genom (grøn). Kredit:Imper
- Kan grafen nanobånd erstatte silicium?
- Stjerneeksplosion i Jordens nærhed
- Moskva smelter i den historiske juni -hedebølge
- Korruptionssmitte:Hvordan juridiske og finansielle virksomheder har større risiko for korruption
- Fuldstændig måneformørkelse begynder, det længste i dette århundrede
- Indien skal gentænke infrastrukturbehovet for at 100 nye smarte byer skal være bæredygtige


