Hvad er Lewis Dot -strukturen for bro3 -1?
1. Grev valenselektroner:
* Brom (BR) har 7 valenselektroner.
* Oxygen (O) har 6 valenselektroner, og der er 3 iltatomer.
* Opladningen -1 tilføjer endnu en elektron.
Samlede valenselektroner:7 + (3 * 6) + 1 =26
2. Bestem det centrale atom:
* Brom (BR) er mindre elektronegativ end ilt, så det vil være det centrale atom.
3. Forbind atomer med enkeltbindinger:
* Placer de tre iltatomer omkring bromatomet og forbinder dem med enkeltbindinger.
4. Distribuer resterende elektroner:
* Hver enkelt binding bruger 2 elektroner, så vi har brugt 6 elektroner indtil videre (3 bindinger * 2 elektroner/binding).
* Vi har 20 elektroner tilbage (26 - 6).
* Placer ensomme par på hvert iltatom for at afslutte deres oktetter (6 elektroner hver) ved hjælp af 18 elektroner.
* Dette efterlader 2 elektroner tilbage.
5. Sted resterende elektroner på det centrale atom:
* Placer de resterende 2 elektroner på bromatomet som et ensomt par.
6. Kontroller for formelle gebyrer:
* Den formelle ladning på hvert iltatom er 0.
* Den formelle ladning på bromatomet er +1 (7 valenselektroner - 6 ikke -bondende elektroner - 1 binding).
* Den samlede ladning af ion er -1 som forventet.
Lewis Dot Structure:
`` `
...
:O:
|
Br
/ \
:O ::o:
...
`` `
Vigtig note: Bromatomet har udvidet sin oktet til at rumme mere end 8 elektroner. Dette er muligt for elementer i periode 3 og derunder.
 Varme artikler
Varme artikler
-
 Partikler fra dagligdags vægmaling kan skade levende organismer, men en ny membran viser høje filt…Kredit:Ann-Kathrin Müller et al., Økotoksikologi og miljøsikkerhed (2022). DOI:10.1016/j.ecoenv.2022.113877 Dispersionsmalinger bruges mest i husholdninger til maling af vægge og lofter. Et tværfag
Partikler fra dagligdags vægmaling kan skade levende organismer, men en ny membran viser høje filt…Kredit:Ann-Kathrin Müller et al., Økotoksikologi og miljøsikkerhed (2022). DOI:10.1016/j.ecoenv.2022.113877 Dispersionsmalinger bruges mest i husholdninger til maling af vægge og lofter. Et tværfag -
 Saturns største måne kan være nøglen til renere motorerTitans atmosfæriske dis, Saturns største måne (billedet her langs Saturns midtersektion), er fanget i dette naturlige farvebillede (boks til venstre). Kredit:NASA Jet Propulsion Laboratory, Space Scie
Saturns største måne kan være nøglen til renere motorerTitans atmosfæriske dis, Saturns største måne (billedet her langs Saturns midtersektion), er fanget i dette naturlige farvebillede (boks til venstre). Kredit:NASA Jet Propulsion Laboratory, Space Scie -
 Forskere udvikler levedygtige, miljøvenligt alternativ til StyrofoamEn miljøvenlig, plantebaseret materiale, der for første gang fungerer bedre end Styrofoam til isolering. Kredit:WSU Washington State University forskere har udviklet en miljøvenlig, plantebaseret
Forskere udvikler levedygtige, miljøvenligt alternativ til StyrofoamEn miljøvenlig, plantebaseret materiale, der for første gang fungerer bedre end Styrofoam til isolering. Kredit:WSU Washington State University forskere har udviklet en miljøvenlig, plantebaseret -
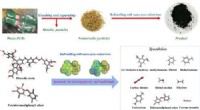 Mod sikrere bortskaffelse af printkortKredit:American Chemical Society Printplader er vitale komponenter i moderne elektronik. Imidlertid, når de har tjent deres formål, de bliver ofte brændt eller begravet på lossepladser, forurener
Mod sikrere bortskaffelse af printkortKredit:American Chemical Society Printplader er vitale komponenter i moderne elektronik. Imidlertid, når de har tjent deres formål, de bliver ofte brændt eller begravet på lossepladser, forurener
- Ny NASA-undersøgelse forbedrer søgningen efter beboelige verdener
- Google-forældreuddannede moonshot-projekter Loon, Vinge
- Apple vil efter sigende frigive en meget billigere iPhone allerede i marts
- Sådan mærker du kulturelle produkter på oversøiske markeder
- Hvilken slags ioner bliver et natriumatom og klor til, når valenselektroner overføres fra den ene …
- Sådan laver man en exosuit, der hjælper med akavede løft


