Hvilken kraft holder nitrogenkrystaller sammen?
Her er hvorfor:
* nitrogen er en ikke-metal: Kvælstof findes som et diatomisk molekyle (N 2 ), og ikke-metaller danner typisk svage bindinger.
* Ingen ioniske eller kovalente bindinger: Nitrogenmolekyler deler ikke elektroner (kovalente binding) eller overfører elektroner (ionisk binding) til dannelse af krystalstrukturen.
* van der Waals Forces: Disse er svage, midlertidige attraktioner mellem molekyler forårsaget af udsving i elektronfordeling. Mens de er svage individuelt, bliver de signifikante i stort antal og holder nitrogenmolekyler sammen i et krystalgitter.
Kortfattet: Selvom det ikke er så stærke som ioniske eller kovalente bindinger, er van der Waals -kræfter de dominerende kræfter, der er ansvarlige for nitrogenstaten ved lave temperaturer.
 Varme artikler
Varme artikler
-
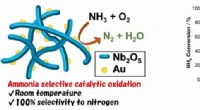 Gennembrud inden for luftrensning med en katalysator, der virker ved stuetemperatur(venstre) Forenklet skematisk oversigt over guldnanopartikler fastgjort til en ramme af nioboxid. (højre) Konverteringseffektivitet af filter med og uden guld, plus selektivitet til omdannelse til nit
Gennembrud inden for luftrensning med en katalysator, der virker ved stuetemperatur(venstre) Forenklet skematisk oversigt over guldnanopartikler fastgjort til en ramme af nioboxid. (højre) Konverteringseffektivitet af filter med og uden guld, plus selektivitet til omdannelse til nit -
 Økologiske krystaller isdannende superkræfterSimuleringer, der viser vandmolekyler (blå) ordnet i et iskrystalgitter (grønt) på forskellige sider af en phloroglucinolkrystal. Kredit:Valeria Molinero/University of Utah I hjertet af skyer er i
Økologiske krystaller isdannende superkræfterSimuleringer, der viser vandmolekyler (blå) ordnet i et iskrystalgitter (grønt) på forskellige sider af en phloroglucinolkrystal. Kredit:Valeria Molinero/University of Utah I hjertet af skyer er i -
 Uran skal erstatte plastik? Kemiens gennembrud kan bane vejen for nye materialerUran kan udføre reaktioner, som ingen tidligere troede var mulige, som kan ændre den måde, industrien fremstiller bulkkemikalier på, polymerer, og forløberne for nye lægemidler og plastik, ifølge nye
Uran skal erstatte plastik? Kemiens gennembrud kan bane vejen for nye materialerUran kan udføre reaktioner, som ingen tidligere troede var mulige, som kan ændre den måde, industrien fremstiller bulkkemikalier på, polymerer, og forløberne for nye lægemidler og plastik, ifølge nye -
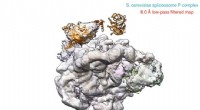 Spliceosomet - nu tilgængeligt i high definitionUCLA-forskere har løst strukturen i høj opløsning i en massiv mobilmaskine, spliceosome, udfylde det sidste store hul i vores forståelse af RNA -splejsningsprocessen, der tidligere var uklar. Kryo -e
Spliceosomet - nu tilgængeligt i high definitionUCLA-forskere har løst strukturen i høj opløsning i en massiv mobilmaskine, spliceosome, udfylde det sidste store hul i vores forståelse af RNA -splejsningsprocessen, der tidligere var uklar. Kryo -e
- Organisk elektronik - hvordan man får kontakt mellem kulstofforbindelser og metal
- Hvorfor kan du ikke have frihandel og redde planeten
- Sådan beregnes en væske Limit
- Elektronkonfiguration for kalium plus klorid?
- Dyr Udover mennesker, der parrer sig til glæde
- Marshalløernes leder appellerer om hjælp til klimaændringer


