Hvad kaldes de stærke tiltrækningskræfter mellem positive og negative regioner molekyler kaldet?
Her er hvorfor:
* ioniske bindinger forekommer, når et atom overfører et elektron fuldstændigt til et andet atom. Denne overførsel skaber ioner:en positivt ladet ion (kation) og en negativt ladet ion (anion). De modsatte afgifter tiltrækker hinanden stærkt og danner en ionisk binding.
Mens ioniske bindinger er den stærkeste type intermolekylær kraft, er der andre typer attraktive kræfter mellem molekyler:
* Hydrogenbindinger: Dette er stærke attraktioner mellem et hydrogenatom kovalent bundet til et stærkt elektronegativt atom (som ilt, nitrogen eller fluor) og et elektronpar i et nærliggende molekyle.
* dipol-dipolinteraktioner: Disse forekommer mellem polære molekyler, hvor den positivt ladede ende af et molekyle tiltrækkes af den negativt ladede ende af et andet molekyle.
* London Dispersion Forces: Dette er svage attraktioner, der opstår som følge af midlertidige udsving i elektronfordeling inden for molekyler.
Det er vigtigt at huske, at styrken af disse kræfter varierer, og den samlede opførsel af et stof afhænger af den kombinerede effekt af alle disse interaktioner.
 Varme artikler
Varme artikler
-
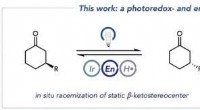 Forskere rapporterer om ny platform for stereokontrolDen overordnede transformation, der kombinerer racemisering af ketonsubstraterne (til venstre) med biokatalytisk reduktion til enantiomert rene alkoholprodukter (i midten), og den vigtigste enaminylra
Forskere rapporterer om ny platform for stereokontrolDen overordnede transformation, der kombinerer racemisering af ketonsubstraterne (til venstre) med biokatalytisk reduktion til enantiomert rene alkoholprodukter (i midten), og den vigtigste enaminylra -
 Billeddannelse af strukturelle ændringer i katalysatorer under reaktionsbetingelserFigur (til venstre) viser den opsætning, der bruges til at fange reversible transformationer i Palladium (Pd) nanopartikler under carbonmonoxid (CO) oxidationsreaktion med operando transmission elektr
Billeddannelse af strukturelle ændringer i katalysatorer under reaktionsbetingelserFigur (til venstre) viser den opsætning, der bruges til at fange reversible transformationer i Palladium (Pd) nanopartikler under carbonmonoxid (CO) oxidationsreaktion med operando transmission elektr -
 Hvedegluten viste sig at genoprette bindinger i skørt menneskehårKredit:Laura Tiitto/public domain Et team af forskere fra Jiangnan University i Kina og University of Nebraska i USA har fundet ud af, at integrering af hvedegluten i en shampoo hjælper med at gen
Hvedegluten viste sig at genoprette bindinger i skørt menneskehårKredit:Laura Tiitto/public domain Et team af forskere fra Jiangnan University i Kina og University of Nebraska i USA har fundet ud af, at integrering af hvedegluten i en shampoo hjælper med at gen -
 Opbygning af bedre beta-peptiderBetapeptidbaserede strukturer kan give bioscaffolding til hjernemasker, der kan hjælpe med at koordinere væksten af neuroner, efter at en patient oplever et slagtilfælde eller traumatisk hjerneskade
Opbygning af bedre beta-peptiderBetapeptidbaserede strukturer kan give bioscaffolding til hjernemasker, der kan hjælpe med at koordinere væksten af neuroner, efter at en patient oplever et slagtilfælde eller traumatisk hjerneskade
- Hvordan forudsiger man den korrekte formel for kombinationsreaktion mellem et ikke-metal og gruppe A…
- Store fremskridt med billeddannelse af en enkelt-molekyle switch
- Superdiamond carbon-bor bure kan fange og udnytte forskellige egenskaber
- Hvad er passagen af slutprodukter fordøjelse til celler et organismeeksempel hvad?
- 5 centrale temaer for biologi
- Brændstof og kemikalier fra planteaffald


