Hvorfor låner atomer elektroner til andre atomer?
* stabilitet: Atomer er mest stabile, når deres yderste elektronskal (også kendt som valensskallen) er fyldt. Dette betyder at have et specifikt antal elektroner, afhængigt af atomet.
* octet regel: Octet -reglen siger, at atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration af otte elektroner i deres valensskal (undtagen brint og helium, som kun har brug for to).
* Deling af elektroner: Atomer med ufuldstændige valensskaller kan opnå stabilitet ved at dele elektroner med andre atomer. Denne deling resulterer i dannelsen af en kovalent binding.
her er et simpelt eksempel:
* brint: Hydrogen har en elektron i sin valensskal og har brug for en mere for at blive stabil.
* ilt: Oxygen har seks elektroner i sin valensskal og har brug for to mere for at blive stabile.
Når et hydrogenatom deler sit elektron med et iltatom, og oxygenatomet deler en af sine elektroner med hvert hydrogenatom, opnår begge atomer en stabil konfiguration. Dette danner et vandmolekyle (H₂O).
Hvorfor sker denne "lån"?
Det er ikke nøjagtigt et lån, men snarere en deling af elektroner. De delte elektroner tiltrækkes af kernerne i begge atomer, hvilket skaber en stærk elektrostatisk attraktion, der holder atomerne sammen.
Kortfattet:
Atomer deler elektroner for at opnå en stabil elektronkonfiguration og opfylde Octet -reglen. Denne deling fører til dannelse af kovalente bindinger, som er ansvarlige for det forskellige række molekyler og forbindelser, der findes i universet.
Sidste artikelGør anti -beslaglæggelse og fedtfedt begge temperaturer begge?
Næste artikelHvad er det tætte metal i fiskesænkere?
 Varme artikler
Varme artikler
-
 At lave rent brint er svært, men forskere har lige løst en stor forhindringHoldets eksperimentelle vandopdelingsapparat. Kredit:Cockrell School of Engineering, University of Texas i Austin I årtier, forskere rundt om i verden har søgt efter måder at bruge solenergi til a
At lave rent brint er svært, men forskere har lige løst en stor forhindringHoldets eksperimentelle vandopdelingsapparat. Kredit:Cockrell School of Engineering, University of Texas i Austin I årtier, forskere rundt om i verden har søgt efter måder at bruge solenergi til a -
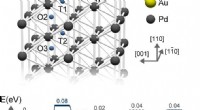 Hvorfor guld-palladium-legeringer er bedre end palladium til brintlagringAu-atomerne destabiliserer kemisorberet brint, dermed øge deres energi og reducere barrieren. Kredit:2018 Shohei Ogura, Institut for Industrividenskab, Universitetet i Tokyo Materialer, der absorb
Hvorfor guld-palladium-legeringer er bedre end palladium til brintlagringAu-atomerne destabiliserer kemisorberet brint, dermed øge deres energi og reducere barrieren. Kredit:2018 Shohei Ogura, Institut for Industrividenskab, Universitetet i Tokyo Materialer, der absorb -
 Raffineret finish til fin fiskeolieProfessor Colin Raston ved Flinders University. Kredit:Flinders University Ikke alle fiskeolier er olier af høj kvalitet, så videnskabsmænd har udviklet en overlegen metode til at hjælpe med at pr
Raffineret finish til fin fiskeolieProfessor Colin Raston ved Flinders University. Kredit:Flinders University Ikke alle fiskeolier er olier af høj kvalitet, så videnskabsmænd har udviklet en overlegen metode til at hjælpe med at pr -
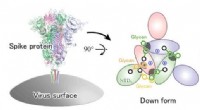 Glykaner er afgørende for COVID-19-infektionMolekylær mekanisme, der ligger til grund for den strukturelle ændring af SARS-CoV-2 spike-proteinet. Kredit:RIKEN En forskergruppe ved RIKEN Center for Computational Science (R-CCS) har fundet ud
Glykaner er afgørende for COVID-19-infektionMolekylær mekanisme, der ligger til grund for den strukturelle ændring af SARS-CoV-2 spike-proteinet. Kredit:RIKEN En forskergruppe ved RIKEN Center for Computational Science (R-CCS) har fundet ud
- Hvordan kunne flammetesten bruges til at påvise natriumchloridurenhed?
- Kvantesamarbejde giver ny tyngdekraft til universets mysterier
- Kan magnetisme hjælpe os med at kontrollere hjernen, på afstand?
- Fairmandering tegner fair distrikter ved hjælp af datavidenskab
- Sådan opbygges en spændingsregulator
- Betyder det, at to sole placeret ved siden af ville passe inde i månerne, der kredser om jorden e…


