Hvilke stoffer kan udføre elektricitet i fast tilstand?
1. Metaller:
* mekanisme: Metaller har et "hav" af frie elektroner, der kan bevæge sig frit gennem det faste stof. Disse elektroner bærer den elektriske strøm.
* Eksempler: Kobber, sølv, guld, aluminium, jern.
2. Nogle ikke-metaller:
* mekanisme: Mens de fleste ikke-metaler er isolatorer, kan nogle elementer som carbon i dens grafitform og silicium udføre elektricitet på grund af tilstedeværelsen af delokaliserede elektroner i deres strukturer.
* Eksempler:
* grafit: Den lagdelte struktur af grafit muliggør bevægelse af elektroner mellem lagene, hvilket gør det til en god leder.
* silicium: Silicon er en halvleder. Det har et begrænset antal frie elektroner ved stuetemperatur, men dens ledningsevne kan øges markant ved doping med urenheder. Denne egenskab gør silicium vigtig for elektronik.
3. Ioniske forbindelser:
* mekanisme: Mens ioniske forbindelser ikke har frie elektroner, kan de udføre elektricitet, når de er smeltet (væske) eller opløst i vand. Dette skyldes, at ionerne bliver mobile og kan bære strømmen.
* Eksempler: Natriumchlorid (NaCl), kaliumbromid (KBR).
4. Halvledere:
* mekanisme: Halvledere har ledningsevne mellem ledere og isolatorer. Deres ledningsevne kan kontrolleres af temperatur, doping og andre faktorer.
* Eksempler: Silicon (Si), Germanium (GE), Gallium Arsenide (GaAs).
Vigtig note: Ikke alle faste stoffer er ledere. Isolatorer som gummi, glas og plast har tæt bundet elektroner, der ikke kan bevæge sig frit, hvilket forhindrer strømmen af elektricitet.
 Varme artikler
Varme artikler
-
 Neutronmicellemålinger giver indsigt i forbedret lægemiddelleveringTyler Cooksey, en kandidatforsker ved University of Houston, bruger ORNLs Bio-SANS-instrument ved High Flux Isotope Reactor til at forstå, hvordan miceller kan forbedres for at skabe mere effektive læ
Neutronmicellemålinger giver indsigt i forbedret lægemiddelleveringTyler Cooksey, en kandidatforsker ved University of Houston, bruger ORNLs Bio-SANS-instrument ved High Flux Isotope Reactor til at forstå, hvordan miceller kan forbedres for at skabe mere effektive læ -
 Elektronisk entropi forbedrer vandspaltningKredit:George Hodan/public domain Forskere har længe vidst, at cerium er det bedste element at bruge, når man spalter vand til brint og ilt - en nøgleteknik til at skabe brintgas til brændstof. Me
Elektronisk entropi forbedrer vandspaltningKredit:George Hodan/public domain Forskere har længe vidst, at cerium er det bedste element at bruge, når man spalter vand til brint og ilt - en nøgleteknik til at skabe brintgas til brændstof. Me -
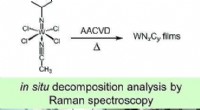 Simuleret kemisk dampaflejring fra en wolframcarbonitridforløberKredit: European Journal of Inorganic Chemistry Tynde film spiller en central rolle i produktionen af elektronik. De kan dyrkes direkte på en substratoverflade gennem processen med kemisk dampa
Simuleret kemisk dampaflejring fra en wolframcarbonitridforløberKredit: European Journal of Inorganic Chemistry Tynde film spiller en central rolle i produktionen af elektronik. De kan dyrkes direkte på en substratoverflade gennem processen med kemisk dampa -
 Polymerprofessor udvikler sikrere komponent til lithiumbatterierEn solid polymer elektrolytfilm, der bliver brugt i lithiumbatterier i forskningen ledet af Dr. Yu Zhu. Kredit:University of Akron Strømkilden til implanteret medicinsk udstyr, elbiler, ubemandede
Polymerprofessor udvikler sikrere komponent til lithiumbatterierEn solid polymer elektrolytfilm, der bliver brugt i lithiumbatterier i forskningen ledet af Dr. Yu Zhu. Kredit:University of Akron Strømkilden til implanteret medicinsk udstyr, elbiler, ubemandede


