Hvilke forbindelser forekommer Octet -udvidelse?
Almindelige eksempler:
* phosphor pentachlorid (PCL5): Fosfor (P) har 5 valenselektroner og danner 5 bindinger med klor (CL) atomer, hvilket resulterer i 10 elektroner omkring P.
* svovl hexafluorid (SF6): Svovl (er) har 6 valenselektroner og danner 6 bindinger med fluor (F) atomer, hvilket resulterer i 12 elektroner omkring S.
* xenon tetrafluorid (XEF4): Xenon (XE) har 8 valenselektroner og danner 4 bindinger med fluor (F) atomer, hvilket resulterer i 12 elektroner omkring XE.
* jodpentafluorid (IF5): Jod (I) har 7 valenselektroner og danner 5 bindinger med fluor (F) atomer, hvilket resulterer i 12 elektroner omkring I.
* fosforsyre (H3PO4): Fosforatomet har 10 elektroner i sin valensskal.
Faktorer, der påvirker Octet -udvidelse:
* Elektronegativitetsforskel: Elementer med en højere elektronegativitetsforskel har en tendens til at danne forbindelser med Octet -ekspansion.
* størrelse på det centrale atom: Større centrale atomer er mere tilbøjelige til at gennemgå Octet -udvidelse, fordi de har flere tilgængelige D -orbitaler.
* binding: Flere obligationer (som dobbelt- eller tredobbelt obligationer) kan også bidrage til Octet -udvidelse.
Bemærk: Octet -udvidelse er ikke den eneste måde for elementer i den tredje periode og videre for at opnå stabilitet. De kan også danne forbindelser med mindre end otte elektroner i deres valensskal, som det ses i forbindelser som bortrifluorid (BF3).
Hvis du gerne vil have mere specifikke eksempler eller have yderligere spørgsmål om Octet -udvidelse, er du velkommen til at spørge!
 Varme artikler
Varme artikler
-
 Forskere kaster lys over nyt billigt materiale til at se i mørketDr. Wendy Sarney bruger den molekylære stråleepitaximaskine ved US Army Research Laboratory til at producere infrarøde detektormaterialer med en ny synteseproces. Kredit:US Army Forskere ved U.S.
Forskere kaster lys over nyt billigt materiale til at se i mørketDr. Wendy Sarney bruger den molekylære stråleepitaximaskine ved US Army Research Laboratory til at producere infrarøde detektormaterialer med en ny synteseproces. Kredit:US Army Forskere ved U.S. -
 Ledig dynamik på CO-dækkede Pt (111) elektroderKredit:CC0 Public Domain Platin er uden tvivl det vigtigste elektrokatalysator materiale, ikke kun fordi det er den bedste enkeltelementkatalysator i en række vigtige elektrokatalytiske reaktioner
Ledig dynamik på CO-dækkede Pt (111) elektroderKredit:CC0 Public Domain Platin er uden tvivl det vigtigste elektrokatalysator materiale, ikke kun fordi det er den bedste enkeltelementkatalysator i en række vigtige elektrokatalytiske reaktioner -
 Konvertering af solenergi til brintbrændstof, med hjælp fra fotosynteseKredit:CC0 Public Domain Global økonomisk vækst kommer med stigende efterspørgsel efter energi, men at øge energiproduktionen kan være udfordrende. For nylig, forskere har opnået rekordeffektivite
Konvertering af solenergi til brintbrændstof, med hjælp fra fotosynteseKredit:CC0 Public Domain Global økonomisk vækst kommer med stigende efterspørgsel efter energi, men at øge energiproduktionen kan være udfordrende. For nylig, forskere har opnået rekordeffektivite -
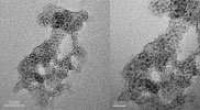 Porøs silica beskytter nikkelkatalysatorTransmissionselektronmikroskopi billeder af (venstre, center) nikkel-silica-katalysator og (til højre) en kommerciel katalysator. Kredit:Genoptrykt fra Ref. 1, Copyright 2018, med tilladelse fra Elsev
Porøs silica beskytter nikkelkatalysatorTransmissionselektronmikroskopi billeder af (venstre, center) nikkel-silica-katalysator og (til højre) en kommerciel katalysator. Kredit:Genoptrykt fra Ref. 1, Copyright 2018, med tilladelse fra Elsev
- Nationalparker er smukke, men nøjsomhed og ulighed forhindrer mange i at nyde dem
- Vil flyselskaberne forbyde Samsung-telefoner efter deres tilbagekaldelse for eksploderende batterier…
- Van der Waals krydsspindventiler uden afstandsstykke
- Hvordan race påvirker lytning under politiske samtaler
- EU's ledere er enige om at reducere emissionerne efter nattens samtaler
- Hvordan en plante regulerer sin vækst


