Hvor mange mol vand H2O produceres fra reaktionen 16 gram methan CH4 med en ubegrænset forsyning af ilt O2. Er dette?
1. Skriv den afbalancerede kemiske ligning:
Ch₄ + 2o₂ → CO₂ + 2H₂O
2. Konverter gram af metan til mol:
* Molmasse CH₄ =12,01 g/mol (C) + 4 * 1,01 g/mol (H) =16,05 g/mol
* Mol ch₄ =16 g / 16,05 g / mol =0,997 mol
3. Brug molforholdet fra den afbalancerede ligning:
* Den afbalancerede ligning viser, at 1 mol Ch₄ producerer 2 mol H₂O.
4. Beregn mol produceret vand:
* Mol H₂O =0,997 mol ch₄ * (2 mol H₂O / 1 mol ch₄) =1,994 mol H₂O
Derfor produceres ca. 1,994 mol vand (H₂O) fra reaktionen af 16 gram metan (CH₄) med en ubegrænset forsyning med ilt (O₂).
Sidste artikelHvorfor inkluderede den periodiske tabel ikke ædelgasser?
Næste artikelEr iltkuldioxid og nitrogen en forbindelse?
 Varme artikler
Varme artikler
-
 Beregningsmæssig forskning beskriver aktiveringsmekanismen for p38-alfaForskere afslørede detaljer om p38 -aktiveringsmekanismen. Billedet repræsenterer de strukturelle ændringer fra den inaktive tilstand (lilla) til den aktive (grøn) foreslået af røntgenkrystallografi.
Beregningsmæssig forskning beskriver aktiveringsmekanismen for p38-alfaForskere afslørede detaljer om p38 -aktiveringsmekanismen. Billedet repræsenterer de strukturelle ændringer fra den inaktive tilstand (lilla) til den aktive (grøn) foreslået af røntgenkrystallografi. -
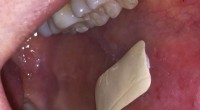 Gips, der sidder inde i munden, kan forbedre behandlingen af orale tilstandeDet bionedbrydelige plaster sidder inde i munden og hjælper med at fremskynde behandlingen af smertefulde sår Kredit:University of Sheffield Et gips, der klæber til indersiden af din mund, rev
Gips, der sidder inde i munden, kan forbedre behandlingen af orale tilstandeDet bionedbrydelige plaster sidder inde i munden og hjælper med at fremskynde behandlingen af smertefulde sår Kredit:University of Sheffield Et gips, der klæber til indersiden af din mund, rev -
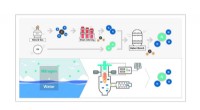 Den nye alkymi i kulstofneutralitet:At forvandle vand til ammoniak med kun vedvarende energi(Øverst) Harber-Bosch-metoden:brug af brint (ekstraheret ved termisk nedbrydning af naturgas) og atmosfærisk nitrogen som reaktanter, denne metode producerer ammoniak ved anvendelse af katalysator und
Den nye alkymi i kulstofneutralitet:At forvandle vand til ammoniak med kun vedvarende energi(Øverst) Harber-Bosch-metoden:brug af brint (ekstraheret ved termisk nedbrydning af naturgas) og atmosfærisk nitrogen som reaktanter, denne metode producerer ammoniak ved anvendelse af katalysator und -
 Laboratoriegennembrud inden for 3-D print af glasEn ny 3D-printteknik, udviklet hos Lawrence Livermore, kunne tillade videnskabsmænd at udskrive glas, der inkorporerer forskellige brydningsindekser i en enkelt flad optik, gør efterbehandling billige
Laboratoriegennembrud inden for 3-D print af glasEn ny 3D-printteknik, udviklet hos Lawrence Livermore, kunne tillade videnskabsmænd at udskrive glas, der inkorporerer forskellige brydningsindekser i en enkelt flad optik, gør efterbehandling billige
- 3-D optiske biopsier inden for rækkevidde takket være fremskridt inden for lysfeltteknologi
- Sådan opløses Rock Salt
- Genbrugsbeton og CO₂ fra luften blev til et nyt byggemateriale
- Buldrende vulkan i Indonesien kan udløse flere tsunamier, eksperter advarer
- Hvorfor skal vi altid vente på affyringsvinduer for at få en raket til rummet?
- Hvordan virker en magnetisk modstandscykel?


