Hvis der kræves varme for, at der opstår en reaktion, hvilken type af den?
Her er hvorfor:
* endotermiske reaktioner absorbere varme fra deres omgivelser. Denne energi bruges til at bryde bindinger i reaktanterne og lade reaktionen fortsætte. Tænk på det som at skulle tilføje energi til at smelte is (som er en endotermisk proces).
* eksotermiske reaktioner På den anden side frigør varme i deres omgivelser. De sker spontant og føler sig ofte varme at røre ved.
Kortfattet:
* endotermiske reaktioner: Varme absorberes, hvilket kræver energiindgang.
* eksotermiske reaktioner: Varmen frigøres, hvilket resulterer i energiudgang.
Sidste artikelEr varme altid frigivet i en kemisk reaktion?
Næste artikelKender nogen formlen for endotermisk reaktion og eksoterm reaktion?
 Varme artikler
Varme artikler
-
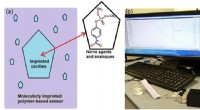 Hurtig påvisning af giftige forbindelserFigur viser (a) princippet for MIP-baserede sensorer, hvor unikke mønstre af målmolekylerne er præget på en polymerbaseret sensorfilm og (b) et eksperiment udføres ved hjælp af den MIP-baserede sensor
Hurtig påvisning af giftige forbindelserFigur viser (a) princippet for MIP-baserede sensorer, hvor unikke mønstre af målmolekylerne er præget på en polymerbaseret sensorfilm og (b) et eksperiment udføres ved hjælp af den MIP-baserede sensor -
 Sojamikroperler er miljøvenlige alternativer til plastmikroperler, der bruges i kosmetik, sæbe pro…Et team på fire nyuddannede i Purdue har udviklet SoyFoliate, en sojamikroperle-teknologi, der kunne tjene som et alternativ til de nyligt forbudte plastikmikroperler, der ofte findes i kosmetiske pro
Sojamikroperler er miljøvenlige alternativer til plastmikroperler, der bruges i kosmetik, sæbe pro…Et team på fire nyuddannede i Purdue har udviklet SoyFoliate, en sojamikroperle-teknologi, der kunne tjene som et alternativ til de nyligt forbudte plastikmikroperler, der ofte findes i kosmetiske pro -
 Maskinlæring til solenergi er en supercomputer dræberKredit:CC0 Public Domain Supercomputere kunne finde sig selv uden for et job takket være en række nye maskinlæringsmodeller, der producerer hurtige, nøjagtige resultater med en normal bærbar compu
Maskinlæring til solenergi er en supercomputer dræberKredit:CC0 Public Domain Supercomputere kunne finde sig selv uden for et job takket være en række nye maskinlæringsmodeller, der producerer hurtige, nøjagtige resultater med en normal bærbar compu -
 COVID-åndedrætstest-kan det være det næste? Forskning siger jaFra venstre:University of Canterbury forskere postdoktor Dr. Fiona Given og lektor Deborah Crittenden ved Biomolecular Interaction Center. Kredit:University of Canterbury Enhver, der har oplevet e
COVID-åndedrætstest-kan det være det næste? Forskning siger jaFra venstre:University of Canterbury forskere postdoktor Dr. Fiona Given og lektor Deborah Crittenden ved Biomolecular Interaction Center. Kredit:University of Canterbury Enhver, der har oplevet e
- Regional modellering af jordsystemer:Gennemgang og fremtidige retninger
- Forskellen mellem optisk densitet og absorbans
- Klimaopvarmningseksperiment finder uventede resultater
- Dansende stjerner og sorte huller i en kosmisk sky af gas:Ny forskning i den fælles hylsterfase
- Nye teknologier, strategier, der udvider søgen efter udenjordisk liv
- Plug and play nanopartikler kunne gøre det lettere at tackle forskellige biologiske mål


