Kender nogen formlen for endotermisk reaktion og eksoterm reaktion?
Sådan adskiller vi dem:
endotermisk reaktion:
* Energi absorberes fra omgivelserne. Dette betyder, at systemet får energi, og omgivelserne mister energi.
* Entalpiændringen (ΔH) er positiv.
* føles koldt at røre ved. (Reaktionen absorberer varme fra omgivelserne, hvilket får omgivelserne til at føle sig koldere.)
Eksoterme reaktion:
* Energi frigøres til omgivelserne. Dette betyder, at systemet mister energi, og omgivelserne får energi.
* Entalpiændringen (ΔH) er negativ.
* føles varm at røre ved. (Reaktionen frigiver varme ind i omgivelserne, hvilket får omgivelserne til at føle sig varmere.)
Nøglepunkter:
* entalpiændring (ΔH): Dette er den vigtigste faktor til at bestemme, om en reaktion er endotermisk eller eksoterm. En positiv ΔH indikerer en endotermisk reaktion, og en negativ ΔH indikerer en eksoterm reaktion.
* Energiflow: Tænk på retning af energiflow - fra omgivelser til system (endotermisk) eller fra system til omgivelser (eksoterme).
Eksempler:
* endotermisk: Meltis, fotosyntese, opløst ammoniumchlorid i vand.
* eksotermisk: Brændende træ, forbrænding, neutraliseringsreaktion (syre + base).
Husk: De specifikke formler for selve reaktionerne afhænger af de involverede kemiske arter. Nøglen er at forstå energiændringen og dens indflydelse på omgivelserne.
 Varme artikler
Varme artikler
-
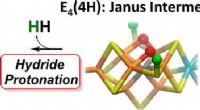 Sætter scenen for brændstofeffektiv gødningKredit:ACS Ammoniak, den primære ingrediens i nitrogenbaserede gødninger, har hjulpet med at brødføde verden siden 1. Verdenskrig. Men at lave ammoniak i industriel skala kræver meget energi, og d
Sætter scenen for brændstofeffektiv gødningKredit:ACS Ammoniak, den primære ingrediens i nitrogenbaserede gødninger, har hjulpet med at brødføde verden siden 1. Verdenskrig. Men at lave ammoniak i industriel skala kræver meget energi, og d -
 Opkogning af en æggemaskine skaber en forbedret bakteriedetektorKredit:Pixabay/CC0 Public Domain Traditionelle fluorescerende farvestoffer til at undersøge bakteriers levedygtighed er giftige og lider af dårlig fotostabilitet - men brugen af VFD har gjort de
Opkogning af en æggemaskine skaber en forbedret bakteriedetektorKredit:Pixabay/CC0 Public Domain Traditionelle fluorescerende farvestoffer til at undersøge bakteriers levedygtighed er giftige og lider af dårlig fotostabilitet - men brugen af VFD har gjort de -
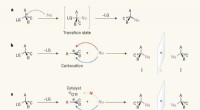 Brug af en SN1-reaktion til at lave kvartære stereocentreSpejlbillede-selektivitet i substitutionsreaktioner. en, I en SN2-reaktion, en reaktant kaldet en nukleofil (Nu; prikker angiver et ensomt elektronpar) angriber et kulstofatom i et organisk molekyle f
Brug af en SN1-reaktion til at lave kvartære stereocentreSpejlbillede-selektivitet i substitutionsreaktioner. en, I en SN2-reaktion, en reaktant kaldet en nukleofil (Nu; prikker angiver et ensomt elektronpar) angriber et kulstofatom i et organisk molekyle f -
 Forskere ser på måder at forbedre standard bremsesystemer påUBCO School of Engineering-forsker Mohammad Arjmand undersøger den nye polymerbaserede bremseklods, som kan revolutionere bremsesystemer i biler og tog. Kredit:UBC Okanagan Selvom det ikke er et s
Forskere ser på måder at forbedre standard bremsesystemer påUBCO School of Engineering-forsker Mohammad Arjmand undersøger den nye polymerbaserede bremseklods, som kan revolutionere bremsesystemer i biler og tog. Kredit:UBC Okanagan Selvom det ikke er et s
- Ny undersøgelse fremhæver første infektion af menneskelige celler under rumflyvning
- En bio-inspireret mekanisk-fotonisk kunstig synapse
- Hvad gør din krop, når du spiser grøntsager på grund af de kulhydrater, der er gemt i plantecell…
- Heavy metal-musik er inkluderende og styret af etiketteregler
- Usædvanlig sjælden jordforbindelse åbner døren til en ny klasse af funktionelle materialer
- Hvordan dannes en løsning?


