Hvordan dannes en løsning?
1. Tiltrækning og interaktion:
* opløsning af opløsningsmiddelinteraktion: Opløsningspartiklerne skal tiltrækkes af opløsningsmiddeltpartiklerne. Denne attraktion kan skyldes forskellige faktorer som:
* Polaritet: Polære opløste stoffer (som salt) opløses godt i polære opløsningsmidler (som vand), mens ikke-polære opløste stoffer (som olie) opløses godt i ikke-polære opløsningsmidler (som benzin).
* Hydrogenbinding: Vand er et godt opløsningsmiddel på grund af dets evne til at danne brintbindinger med mange opløste stoffer.
* ion-dipol-interaktion: Ioner kan tiltrækkes af de modsatte poler af polære molekyler.
* Solute-Solute-interaktion: Solute -partiklerne skal overvinde de attraktive kræfter mellem sig selv for at bryde fra hinanden.
2. Opløsningsproces:
* opløsningsmiddelmolekyler omgiver de opløste partikler: Opløsningsmiddelmolekylerne klynger omkring de opløste partikler og bryder dem fra hinanden. Dette er kendt som solvation .
* spredning: De individuelle opløste partikler er spredt i hele opløsningsmidlet og danner en homogen blanding.
3. Når ligevægt:
* opløsning og krystallisation: Processen med opløsning og krystallisation forekommer samtidig. Opløsning er processen med opløste partikler, der bryder væk fra det faste stoffer og går i opløsning, mens krystallisation er processen med opløste opløste opløste partikler, der samles og danner et fast stof igen.
* ligevægt: Når opløsningshastigheden er lig med krystallisationshastigheden, en mættet opløsning dannes, hvor ikke mere opløst stof kan opløses ved den temperatur.
Nøglepunkter:
* homogen blanding: En opløsning er en homogen blanding, hvilket betyder, at opløsningen er ensartet fordelt over opløsningsmidlet.
* opløselighed: Mængden af opløst stof, der kan opløses i en given mængde opløsningsmiddel ved en bestemt temperatur, er kendt som dens opløselighed.
* faktorer, der påvirker opløselighed: Flere faktorer kan påvirke opløseligheden af et opløst stof, herunder temperatur, tryk og arten af opløst og opløsningsmiddel.
Eksempler:
* sukker i vand: Sukker (opløst) opløses i vand (opløsningsmiddel), fordi begge er polære og danner brintbindinger.
* salt i vand: Salt (opløst) opløses i vand (opløsningsmiddel) på grund af ion-dipolinteraktioner.
* olie i vand: Olie (opløst) opløses ikke i vand (opløsningsmiddel), fordi de begge er ikke-polære og ikke kan danne stærke attraktive kræfter.
At forstå, hvordan der dannes løsninger, er afgørende inden for forskellige områder, herunder kemi, biologi og medicin.
Sidste artikelHvad sker der, når du opløser sukker i vand?
Næste artikelHvad er de opløsningsmidler, der vil opløse smør?
 Varme artikler
Varme artikler
-
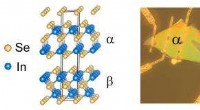 Ny enhed kan gøre varmeenergi til en levedygtig brændstofkildeDet venstre panel viser de skematiske gitterstrukturer i alfa-beta In2Se3 van der Waals metal-halvlederforbindelse, og det højre panel viser en optisk mikroskop af en forbindelsesenhed. Kredit:Yi Gu
Ny enhed kan gøre varmeenergi til en levedygtig brændstofkildeDet venstre panel viser de skematiske gitterstrukturer i alfa-beta In2Se3 van der Waals metal-halvlederforbindelse, og det højre panel viser en optisk mikroskop af en forbindelsesenhed. Kredit:Yi Gu -
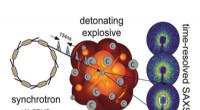 De første amerikanske eksperimenter nogensinde på et nyt røntgenanlæg kan føre til bedre eksplo…Detonationen af kulstofrige højsprængstoffer giver fast kulstof som en hovedbestanddel af produktblandingen, og afhængigt af de termodynamiske forhold bag stødfronten, en række carbonallotroper og -
De første amerikanske eksperimenter nogensinde på et nyt røntgenanlæg kan føre til bedre eksplo…Detonationen af kulstofrige højsprængstoffer giver fast kulstof som en hovedbestanddel af produktblandingen, og afhængigt af de termodynamiske forhold bag stødfronten, en række carbonallotroper og - -
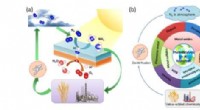 Fotokemisk nitrogenfiksering – åbner nye udsigter mod en bæredygtig energifremtid(a) En oversigt over N2-kredsløbet og cirkulationen af N2 i forskellige former. (b) Illustration af den avancerede forskning i udviklingen af fotokatalysatorer til N2-fiksering. Kredit:A*STAR og W
Fotokemisk nitrogenfiksering – åbner nye udsigter mod en bæredygtig energifremtid(a) En oversigt over N2-kredsløbet og cirkulationen af N2 i forskellige former. (b) Illustration af den avancerede forskning i udviklingen af fotokatalysatorer til N2-fiksering. Kredit:A*STAR og W -
 Ikke alle naturens lagdelte strukturer er hårde som dyreskaller og gevirer, undersøgelse finderAnkerpiggene, der holder svampearten Euplectella aspergillum til havbunden, har en indviklet lagdelt indre struktur. Lignende lagdelte strukturer er kendt for at øge sejheden af materialer som knogl
Ikke alle naturens lagdelte strukturer er hårde som dyreskaller og gevirer, undersøgelse finderAnkerpiggene, der holder svampearten Euplectella aspergillum til havbunden, har en indviklet lagdelt indre struktur. Lignende lagdelte strukturer er kendt for at øge sejheden af materialer som knogl


