Hvad er massen af lithiumoxid lavet af 20 g carbonat?
1. Skriv den afbalancerede kemiske ligning:
Li₂co₃ (S) → Li₂o (S) + CO₂ (G)
2. Beregn den molære masse af Li₂co₃ og Li₂o:
* Li₂co₃:(2 * 6,94 g/mol Li) + (12,01 g/mol C) + (3 * 16,00 g/mol O) =73,89 g/mol
* Li₂o:(2 * 6,94 g/mol Li) + (16,00 g/mol O) =29,88 g/mol
3. Konverter massen af Li₂co₃ til mol:
20 g li₂co₃ * (1 mol li₂co₃ / 73,89 g li₂co₃) =0,271 mol li₂co₃
4. Brug molforholdet fra den afbalancerede ligning til at finde mol af Li₂o:
Fra den afbalancerede ligning producerer 1 mol li₂co₃ 1 mol li₂o. Derfor har vi 0,271 mol Li₂o.
5. Konverter mol Li₂o til gram:
0,271 mol li₂o * (29,88 g li₂o / 1 mol li₂o) = 8,11 g li₂o
Derfor er massen af lithiumoxid fremstillet af 20 g lithiumcarbonat ca. 8,11 gram
Sidste artikelSandt for falske meget få mineraler er forbindelser?
Næste artikelHvad får du, når lithium og ilt kombineres?
 Varme artikler
Varme artikler
-
 En ny generation af kunstige nethinder baseret på 2-D materialerKredit:CC0 Public Domain Forskere rapporterer, at de med succes har udviklet og testet verdens første ultratynde kunstige nethinde, der kunne forbedre den eksisterende implanterbare visualiserings
En ny generation af kunstige nethinder baseret på 2-D materialerKredit:CC0 Public Domain Forskere rapporterer, at de med succes har udviklet og testet verdens første ultratynde kunstige nethinde, der kunne forbedre den eksisterende implanterbare visualiserings -
 Brug af radikaliserede NOₓ-derivater understøttet på metaloxiderGrafisk billede af forskningen. Kredit:Korea Institute of Science and Technology (KIST) INGEN x (X=1 eller 2), der udsendes fra papirvarer/mobilkilder, anses traditionelt for at være berygtede,
Brug af radikaliserede NOₓ-derivater understøttet på metaloxiderGrafisk billede af forskningen. Kredit:Korea Institute of Science and Technology (KIST) INGEN x (X=1 eller 2), der udsendes fra papirvarer/mobilkilder, anses traditionelt for at være berygtede, -
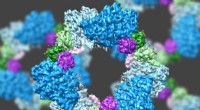 Forskere leverer højopløsnings glimt af enzymstrukturVed hjælp af en state-of-the-art type elektronmikroskopi, et MIT-ledet hold har opdaget strukturen af et enzym, der er afgørende for at opretholde en tilstrækkelig forsyning af DNA-byggesten i menne
Forskere leverer højopløsnings glimt af enzymstrukturVed hjælp af en state-of-the-art type elektronmikroskopi, et MIT-ledet hold har opdaget strukturen af et enzym, der er afgørende for at opretholde en tilstrækkelig forsyning af DNA-byggesten i menne -
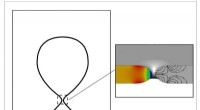 Fund af mikrobobler kan reducere kemikalier, vandforbrug i fødevareforarbejdningCarlos Corvalan og Jiakai Lu modellerede skabelsen af mikrobobler, som kan være nyttig til rengøring af fødevareforarbejdningsudstyr med færre kemikalier og mindre vand. En mikroboble, der dukker op
Fund af mikrobobler kan reducere kemikalier, vandforbrug i fødevareforarbejdningCarlos Corvalan og Jiakai Lu modellerede skabelsen af mikrobobler, som kan være nyttig til rengøring af fødevareforarbejdningsudstyr med færre kemikalier og mindre vand. En mikroboble, der dukker op
- Hvad er ligningen for reaktion mellem salicylsyre og acetylchlorid?
- Sø skabt af kulaffaldsskred oversvømmer den bosniske motorvej
- Løvfældende træer opvejer kulstoftab fra borealbrande i Alaska, ny undersøgelse finder
- Sådan fungerer dampmaskiner
- Hvor mange miles rejser solen på 1 minut?
- Arkæologien ændrer sig, langsomt. Men det er stadig for bundet i kolonial praksis


