Hvor mange fulde elektroner har svovl?
Her er hvorfor:
* Elektronkonfiguration: Svovls elektronkonfiguration er 1S² 2S² 2p⁶ 3S² 3P⁴.
* Fuldskaller: De to første elektronskaller (1s og 2s) er fuldstændigt fyldt med 2 elektroner hver. Subshellet 2p er også fyldt med 6 elektroner. Dette betyder, at de to første elektronskaller (1s, 2s og 2p) er helt fulde.
* delvis skal: 3P -underskalet har 4 elektroner. Det har brug for yderligere 2 elektroner for at være fuldt fyldt.
Derfor har svovl 6 Fuld elektroner i sine 1s, 2s og 2p skaller.
Sidste artikelHvad er formlen for magnesiumhydrogenphosphit?
Næste artikelHvordan kan elementer har en diatomiske molekyler?
 Varme artikler
Varme artikler
-
 ORNL undersøger komplekse uranoxider med hjælp fra CADES ressourcerORNL-medarbejdere (fra venstre) Ashley Shields, Michael Galloway, Ketan Maheshwari og Andrew Miskowiec samarbejder om et projekt, der fokuserer på at forudsige og analysere krystalstrukturer af nye ur
ORNL undersøger komplekse uranoxider med hjælp fra CADES ressourcerORNL-medarbejdere (fra venstre) Ashley Shields, Michael Galloway, Ketan Maheshwari og Andrew Miskowiec samarbejder om et projekt, der fokuserer på at forudsige og analysere krystalstrukturer af nye ur -
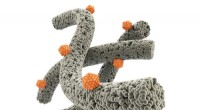 Nanosensorer forbedrer påvisning af sygdomsbiomarkører i udåndet åndeKAIST-forskere designede nanofibre (grå) med proteinindkapslede katalysatorer (orange) for at øge følsomheden og selektiviteten af åndedrætssensorer til sygdomsdetektion. Kredit:KAIST Forskere f
Nanosensorer forbedrer påvisning af sygdomsbiomarkører i udåndet åndeKAIST-forskere designede nanofibre (grå) med proteinindkapslede katalysatorer (orange) for at øge følsomheden og selektiviteten af åndedrætssensorer til sygdomsdetektion. Kredit:KAIST Forskere f -
 Verdensnyhed:Ny polymer går en tur, når den er oplystTimelapse-billede af gåapparatet. Kredit:Bart van Overbeeke. Forskere ved Eindhoven University of Technology og Kent State University har udviklet et nyt materiale, der kan bølge og derfor drive s
Verdensnyhed:Ny polymer går en tur, når den er oplystTimelapse-billede af gåapparatet. Kredit:Bart van Overbeeke. Forskere ved Eindhoven University of Technology og Kent State University har udviklet et nyt materiale, der kan bølge og derfor drive s -
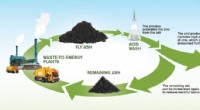 Udvinding af ædle zink fra affaldsaskeEn illustration af processen til genvinding af zink. Kredit:Yen Strandqvist/Chalmers Tekniske Universitet Forbrænding af fast affald producerer årligt millioner af tons affald flyveaske i Europa;
Udvinding af ædle zink fra affaldsaskeEn illustration af processen til genvinding af zink. Kredit:Yen Strandqvist/Chalmers Tekniske Universitet Forbrænding af fast affald producerer årligt millioner af tons affald flyveaske i Europa;


