Hvad er forskellen mellem en heterogen reaktion og homogen reaktion?
homogen reaktion:
* Alle reaktanter og produkter er i den samme fase. Dette kan være:
* Alle gasser (f.eks. Forbrænding af metan:ch₄ (g) + 2o₂ (g) → co₂ (g) + 2H₂O (g))
* Alle væsker (f.eks. Reaktionen af ethanol og vand:ch₃ch₂oh (l) + h₂o (l) → ch₃ch₂oh (aq))
* Alle faste stoffer (f.eks. Reaktionen af fast natrium og klor:2NA (S) + CL₂ (S) → 2NACl (S))
* reaktion forekommer gennem hele blandingen. Der er ingen forskellige grænser mellem reaktanter.
* generelt hurtigere På grund af lettere blanding og interaktion mellem molekyler.
heterogen reaktion:
* reaktanter og produkter er i forskellige faser. Dette kan være:
* Gas-solid (f.eks. Forbrænding af træ:C (S) + O₂ (G) → CO₂ (G))
* Liquid-solid (f.eks. Opløsningen af sukker i vand:c₁₂h₂₂o₁₁ (s) + h₂o (l) → c₁₂h₂₂o₁₁ (aq))
* Liquid-liquid (f.eks. Ekstraktion af olie fra sojabønner)
* Gas-væske (f.eks. Absorption af kuldioxid i vand:CO₂ (G) + H₂O (L) → H₂CO₃ (AQ))
* reaktion forekommer kun ved grænsefladen mellem faserne. Dette skaber en overfladearealbegrænsning.
* generelt langsommere På grund af behovet for molekyler til at overvinde fasegrænser for at interagere.
Her er en tabel, der opsummerer de vigtigste forskelle:
| Funktion | Homogen reaktion | Heterogen reaktion |
| --- | --- | --- |
| fase | Alle reaktanter og produkter i samme fase | Reaktanter og produkter i forskellige faser |
| reaktionssted | I hele blandingen | Ved grænsefladen mellem faser |
| rate | Generelt hurtigere | Generelt langsommere |
| Eksempler | Forbrænding af metan, opløst sukker i vand | Brænding af træ, opløst calciumcarbonat i syre |
At forstå disse forskelle er afgørende for at forudsige reaktionshastigheder, designe reaktorer og analysere kemiske processer.
 Varme artikler
Varme artikler
-
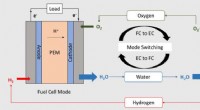 Ny katalysator hjælper med at kombinere brændselscelle, batteri i én enhedKredit:Washington University i St. Louis En enkelt enhed, der både genererer brændstof og oxidant fra vand og, når en kontakt drejes, omdanner brændstof og ilt til elektricitet og vand, har en ræk
Ny katalysator hjælper med at kombinere brændselscelle, batteri i én enhedKredit:Washington University i St. Louis En enkelt enhed, der både genererer brændstof og oxidant fra vand og, når en kontakt drejes, omdanner brændstof og ilt til elektricitet og vand, har en ræk -
 Ny teori for, hvordan snefnug vokserKredit:Pixabay/CC0 Public Domain Forskere har opdaget, hvad der driver det sarte og komplekse mikrokosmos af små terrasser, pyramider og kratere fundet på overfladen af is. Disse miniature struk
Ny teori for, hvordan snefnug vokserKredit:Pixabay/CC0 Public Domain Forskere har opdaget, hvad der driver det sarte og komplekse mikrokosmos af små terrasser, pyramider og kratere fundet på overfladen af is. Disse miniature struk -
 Hæmmer eller fremmer zink vækst af nyresten? Godt, beggeKredit:CC0 Public Domain Der skete en sjov ting på vejen til at opdage, hvordan zink påvirker nyresten - to forskellige teorier dukkede op, hver modsiger hinanden. Et:Zink stopper væksten af de
Hæmmer eller fremmer zink vækst af nyresten? Godt, beggeKredit:CC0 Public Domain Der skete en sjov ting på vejen til at opdage, hvordan zink påvirker nyresten - to forskellige teorier dukkede op, hver modsiger hinanden. Et:Zink stopper væksten af de -
 Jern-medieret kræftcelle aktivitet:En ny reguleringsmekanismeMesenkymale stamceller (til højre) er forbundet med metastatisk spredning, modstandsdygtighed over for konventionel kemoterapi og tilbagefald. Under overgangen til denne tilstand, proteinet CD44 overt
Jern-medieret kræftcelle aktivitet:En ny reguleringsmekanismeMesenkymale stamceller (til højre) er forbundet med metastatisk spredning, modstandsdygtighed over for konventionel kemoterapi og tilbagefald. Under overgangen til denne tilstand, proteinet CD44 overt
- Hvilke forbindelser giver det højeste smeltepunkt C2H6 CL2 ASCL3 NE VER?
- COVID-19 har negativt påvirket, hvordan revisorer arbejder
- Stort potentiale i at regulere planters drivhusgasudledning
- Fra kameraer til computere, nyt materiale kan ændre den måde, vi arbejder og leger på
- At dræbe kun få dyr vil ikke gøre nogen skade - eller vil det?
- Præcise data for forbedret kystlinjebeskyttelse


