Er atommassen og antallet direkte proportionalt med hinanden?
Her er hvorfor:
* atomnummer: Dette repræsenterer antallet af protoner i en atoms kerne. Det definerer selve elementet.
* atommasse: Dette er den gennemsnitlige masse af et atom af et element under hensyntagen til de forskellige isotoper (atomer af det samme element med forskellige antal neutroner).
Den vigtigste forskel: Mens atomnummer kun tegner sig for protoner, overvejer atommasse både protoner og neutroner.
Eksempel:
* Carbon har et atomnummer på 6 (6 protoner).
* Den mest almindelige isotop af kulstof har 6 neutroner, hvilket gør sin atommasse ca. 12 (6 protoner + 6 neutroner).
* Der er dog andre isotoper af kulstof, som carbon-14, der har 8 neutroner, hvilket gør sin atommasse ca. 14.
Derfor, mens atommassen generelt øges med atomnummeret, er det ikke et simpelt lineært forhold. Tilstedeværelsen af forskellige isotoper og det forskellige antal neutroner, de har, gør forholdet mere komplekst.
 Varme artikler
Varme artikler
-
 Kemiske bølger guider til fremtidens katalysatorerSpiralstrukturer på krystallen. Kredit:TU Wien Spektakulære elektronmikroskopbilleder på TU Wien fører til vigtige fund:Kemiske reaktioner kan producere spirallignende multi-frekvensbølger og derm
Kemiske bølger guider til fremtidens katalysatorerSpiralstrukturer på krystallen. Kredit:TU Wien Spektakulære elektronmikroskopbilleder på TU Wien fører til vigtige fund:Kemiske reaktioner kan producere spirallignende multi-frekvensbølger og derm -
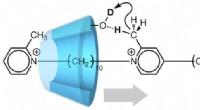 Molekylær maskine udnytter bevægelse i en enkelt retningFig.1. En pseudo-rotaxan (kunstig molekylær maskine), hvor translationel bevægelse af α-cyclodextrin (α-CD) falder sammen med deuteration. Når α-CD bevæger sig langs to-stationsaksemolekylet som vist
Molekylær maskine udnytter bevægelse i en enkelt retningFig.1. En pseudo-rotaxan (kunstig molekylær maskine), hvor translationel bevægelse af α-cyclodextrin (α-CD) falder sammen med deuteration. Når α-CD bevæger sig langs to-stationsaksemolekylet som vist -
 Ny miljøvenlig elektrokemisk reaktion kan syntetisere nyttige halvledermaterialerElektrokemisk opsætning til syntese af thienoacenderivater. Kredit:Okayama University 2020 Organiske solceller har en række anvendelser inden for elektronik, især i udviklingen af nye elektronis
Ny miljøvenlig elektrokemisk reaktion kan syntetisere nyttige halvledermaterialerElektrokemisk opsætning til syntese af thienoacenderivater. Kredit:Okayama University 2020 Organiske solceller har en række anvendelser inden for elektronik, især i udviklingen af nye elektronis -
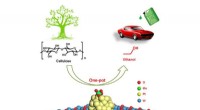 Forskere udvikler en kemokatalytisk tilgang til one-pot-reaktion af celluloseholdig ethanolOne-pot produktion af celluloseholdig ethanol via tandem katalyse over multifunktionel Mo/Pt/WOx katalysator Kredit:WANG Aiqin Forskere ved Dalian Institute of Chemical Physics (DICP) fra det kine
Forskere udvikler en kemokatalytisk tilgang til one-pot-reaktion af celluloseholdig ethanolOne-pot produktion af celluloseholdig ethanol via tandem katalyse over multifunktionel Mo/Pt/WOx katalysator Kredit:WANG Aiqin Forskere ved Dalian Institute of Chemical Physics (DICP) fra det kine
- Forskere trykker regnbuefarvestoffer på skinnende chokolade
- Hvad er rovdyr fra Savanna afhængig af for mad?
- Saltmarker lagrer kulstof, men deres klimapåvirkning kan være blevet overvurderet
- Ny forskning kaster lys over, hvordan ekspertkortmagere ser verden anderledes
- Forskere opdager en ny bindingsmekanisme mellem små og gigantiske partikler
- Findes der stadig store uopdagede arter?


