Hvordan kan ikke-metalelementer opnå en stabil elektron-shell-struktur som de ædle gasser?
* ædle gaskonfiguration: Noble gasser har en fuld ydre skal af elektroner, hvilket gør dem meget stabile og ureaktive. Dette skyldes, at de har en komplet oktet (8 elektroner) i deres yderste skal, bortset fra helium, der har en duet (2 elektroner).
* Ikke-metaler og elektronforstærkning: Ikke-metaller har en tendens til at få elektroner for at opnå denne samme stabile konfiguration. De har en høj elektronegativitet, hvilket betyder, at de stærkt tiltrækker elektroner.
* kovalent binding: For at opnå stabilitet deler ikke-metaler elektroner med andre ikke-metaller gennem kovalente bindinger. Ved at dele elektroner kan begge involverede atomer fuldføre deres yderste skaller.
Eksempel:
* Overvej elementet klor (CL) , som har 7 elektroner i sin yderste skal. Det har brug for endnu en elektron for at afslutte sin oktet.
* Klor kan danne en kovalent binding med et andet kloratom. Hvert kloratom deler det ene elektron med det andet, hvilket resulterer i et delt par elektroner. Dette afslutter okteten for begge kloratomer, hvilket gør dem mere stabile.
Andre måder ikke-metaller opnår stabilitet:
* ionisk binding: Ikke-metaller kan også opnå stabilitet ved at vinde elektroner fra metaller og danne ioniske bindinger. I dette tilfælde bliver ikke-metalen en negativt ladet ion (anion), mens metallet bliver en positivt ladet ion (kation).
Kortfattet:
Ikke-metalelementer opnår en stabil elektronkonfiguration ved at vinde elektroner gennem kovalent binding med andre ikke-metaler eller ionisk binding med metaller. Dette giver dem mulighed for at efterligne den stabile elektronkonfiguration af ædelgasser, hvilket gør dem mindre reaktive.
Sidste artikelHvad er chloroplsats?
Næste artikelEr atommassen og antallet direkte proportionalt med hinanden?
 Varme artikler
Varme artikler
-
 Video:Hvad er livet? Og vil vi finde det på andre planeter?Kredit:The American Chemical Society Kemi hjælper os med at finde ud af, hvordan livet kom i gang på Jorden og giver os molekyler at kigge efter på andre planeter. I denne episode af reaktioner, v
Video:Hvad er livet? Og vil vi finde det på andre planeter?Kredit:The American Chemical Society Kemi hjælper os med at finde ud af, hvordan livet kom i gang på Jorden og giver os molekyler at kigge efter på andre planeter. I denne episode af reaktioner, v -
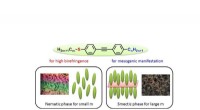 Svovl forbedrer dobbeltbrydningen til udvikling af flydende krystallinske molekylerBilleder af alkylthiogruppestavlignende molekyler, der udviser flydende krystallinitet ved stuetemperatur, og fasestrukturerne. Kredit:Toyohashi University of Technology Et team af forskere ledet
Svovl forbedrer dobbeltbrydningen til udvikling af flydende krystallinske molekylerBilleder af alkylthiogruppestavlignende molekyler, der udviser flydende krystallinitet ved stuetemperatur, og fasestrukturerne. Kredit:Toyohashi University of Technology Et team af forskere ledet -
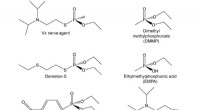 Protein, der kunne forhindre kemisk krigsangreb oprettetVX-nervegiften, dens simulanter og nedbrydningsprodukter. VX ligner kemisk både almindelige organofosfater, der bruges som insekticider (venstre) (midten og nederst) og dens stadig giftige nedbrydning
Protein, der kunne forhindre kemisk krigsangreb oprettetVX-nervegiften, dens simulanter og nedbrydningsprodukter. VX ligner kemisk både almindelige organofosfater, der bruges som insekticider (venstre) (midten og nederst) og dens stadig giftige nedbrydning -
 Anatomi af en acnebehandlingKredit:CC0 Public Domain Sarecyclin, et lægemiddel godkendt til brug i USA i 2018, er det første nye antibiotikum godkendt til behandling af acne i mere end 40 år. Nu, forskere ved Yale og Univers
Anatomi af en acnebehandlingKredit:CC0 Public Domain Sarecyclin, et lægemiddel godkendt til brug i USA i 2018, er det første nye antibiotikum godkendt til behandling af acne i mere end 40 år. Nu, forskere ved Yale og Univers
- Forudsætninger for livet findes allerede for 3,5 milliarder år siden
- Nyt bevis afslører grundlæggende grænser for videnskabelig viden
- Centauro:En ny katastrofeberedskabsrobot til at hjælpe redningsarbejdere med at operere sikkert
- Indfødt landbrug har potentiale til at bidrage til fødevarebehov under klimaændringer
- Hvad er det mest tætte objekt i universet, og hvordan er dets tæthed sammenlignet med andre himmel…
- Er nøglen til at sætte gang i klimahandlingen et spil?


