For de fleste stoffer er partikler behov for svar imellem og pakket fast tilstand?
Her er hvorfor:
* faste stoffer: Partikler i faste stoffer er tæt pakket sammen i en fast, stiv struktur. De har meget lidt frihed til at bevæge sig rundt.
* væsker: Partikler i væsker er tættere sammen end i gasser, men de kan bevæge sig mere frit end i faste stoffer. De er ikke fastgjort i en stiv struktur, så væsker kan flyde og tage formen på deres beholder.
Tænk på det sådan:
* fast: Forestil dig en tæt pakket kasse med appelsiner. Oranges (partikler) kan ikke bevæge sig meget.
* væske: Forestil dig, at appelsinerne nu er i en taske. De er stadig tæt på hinanden, men de kan glide rundt og skifte.
* gas: Forestil dig, at appelsinerne er spredt over et stort rum. De er langt fra hinanden og bevæger sig frit.
Sidste artikelHvorfor er fysiske og kemiske egenskaber vigtige for videnskabsmand?
Næste artikelHvilket salt bruges i maling?
 Varme artikler
Varme artikler
-
 Forskere finder en billigere måde at oplyse OLED-skærme påKemiker Mark E. Thompson har nye kobberbaserede lysdioder opfundet af ham og et team af kemikere, der kunne være en billigere løsning for tv- og smartphone-skærme til at producere farven-herunder blå-
Forskere finder en billigere måde at oplyse OLED-skærme påKemiker Mark E. Thompson har nye kobberbaserede lysdioder opfundet af ham og et team af kemikere, der kunne være en billigere løsning for tv- og smartphone-skærme til at producere farven-herunder blå- -
 Fremstilling af fremtiden med en ny miljøvenlig polymeriseringsmetodeHalogenbindende organokatalysatorer (R-Hal-B) lettede jævn levende kationisk polymerisation af vinyl (R-Cl) monomerer ved stuetemperatur, producerer en god mængde rent udbytte, åbne døre for at opnå m
Fremstilling af fremtiden med en ny miljøvenlig polymeriseringsmetodeHalogenbindende organokatalysatorer (R-Hal-B) lettede jævn levende kationisk polymerisation af vinyl (R-Cl) monomerer ved stuetemperatur, producerer en god mængde rent udbytte, åbne døre for at opnå m -
 Forskere har opdaget, hvordan blodorme fremstiller deres unikke kobbertænderVenstre:Billede af den udbøjede snabel af Glycera dibranchiata med dens fire fritlagte kæber, højre:Scanningselektronmikroskopbillede af en Glycera-kæbe (Skalastang, 0,5 mm). Kredit:Matter/Wonderly et
Forskere har opdaget, hvordan blodorme fremstiller deres unikke kobbertænderVenstre:Billede af den udbøjede snabel af Glycera dibranchiata med dens fire fritlagte kæber, højre:Scanningselektronmikroskopbillede af en Glycera-kæbe (Skalastang, 0,5 mm). Kredit:Matter/Wonderly et -
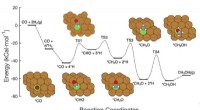 Machine learning framework ID'er mål til forbedring af katalysatorerDenne grafik viser syvtrins reaktionsvejen for CO-hydrogenering til methanol over kobberbaserede katalysatorer, inklusive reaktanterne på hvert trin, skematiske atomarrangementer af mellemprodukterne
Machine learning framework ID'er mål til forbedring af katalysatorerDenne grafik viser syvtrins reaktionsvejen for CO-hydrogenering til methanol over kobberbaserede katalysatorer, inklusive reaktanterne på hvert trin, skematiske atomarrangementer af mellemprodukterne
- Fysikken i ægdråpsvidenskabsprojekter
- Google for at vise, hvem der står bag amerikanske politiske annoncer
- Sikkert på Mars, InSight folder sine arrays ud og tager nogle billeder
- Forskere udtænker en tilgang til at reducere skævheder i datasæt for computersyn
- Kvalitetssikring af autonome systemer
- Positive lærerforhold kan reducere kriminalitet


