Hvad er atomer, der let mister elektroner?
Her er hvorfor:
* Metallisk binding: Metaller har en unik type binding, hvor deres yderste elektroner holdes løst og kan let bevæge sig mellem atomer. Dette skaber et "hav af elektroner", der giver mulighed for god ledningsevne af varme og elektricitet.
* lav ioniseringsenergi: Metaller har generelt lave ioniseringsenergier. Dette betyder, at det kræver relativt lidt energi at fjerne et elektron fra et metalatom, hvilket gør dem ivrige efter at miste elektroner og blive positivt ladede ioner (kationer).
Eksempler på metaller, der let mister elektroner:
* alkalimetaller (gruppe 1): Lithium (Li), natrium (NA), kalium (K) osv. Disse metaller har kun en valenselektron, hvilket gør dem ekstremt reaktive og tilbøjelige til at miste denne elektron til dannelse af +1 ioner.
* alkaliske jordmetaller (gruppe 2): Beryllium (BE), magnesium (Mg), calcium (CA) osv. Disse metaller har to valenselektroner og har en tendens til at miste dem til dannelse af +2 ioner.
* Overgangsmetaller: Mange overgangsmetaller kan miste elektroner for at danne forskellige positive ioner og bidrage til deres forskellige kemiske opførsel.
Vigtig note: Ikke alle metaller mister elektroner med den samme lethed. Deres reaktivitet og tendens til at miste elektroner afhænger af deres position på den periodiske tabel og andre faktorer som elektronegativitet.
Sidste artikelFordele kg Ulemper ved at bruge uorganiske kølemidler?
Næste artikelHvad er de 3 dele af en konklusion i videnskabelig metode?
 Varme artikler
Varme artikler
-
 Nyt materiale kan frigøre potentialet for brintdrevne køretøjerKredit: Energi- og miljøvidenskab (2018). DOI:10.1039/C8EE02499E Forskere har opdaget et nyt materiale, der kunne holde nøglen til at frigøre potentialet i brintdrevne køretøjer. Mens verden ser
Nyt materiale kan frigøre potentialet for brintdrevne køretøjerKredit: Energi- og miljøvidenskab (2018). DOI:10.1039/C8EE02499E Forskere har opdaget et nyt materiale, der kunne holde nøglen til at frigøre potentialet i brintdrevne køretøjer. Mens verden ser -
 Forskerteam udvikler en ny klasse bløde materialerShifeng Nian og ph.d. studerende Jinchang Zhu ilægger blækket i en sprøjte til 3D -print. Kredit:University of Virginia Jeg tror, du er stille. Dette var den mest brugte sætning i 2020, ifølge H
Forskerteam udvikler en ny klasse bløde materialerShifeng Nian og ph.d. studerende Jinchang Zhu ilægger blækket i en sprøjte til 3D -print. Kredit:University of Virginia Jeg tror, du er stille. Dette var den mest brugte sætning i 2020, ifølge H -
 Hurtige og pålidelige tests for legionellabakterier i vandKredit:Giovanni Cancemi, Shutterstock En fuldautomatisk testanordning kan nu installeres på vandsteder, der er mistænkt for forurening med legionella-bakterier. Enheden lover mere pålidelige resul
Hurtige og pålidelige tests for legionellabakterier i vandKredit:Giovanni Cancemi, Shutterstock En fuldautomatisk testanordning kan nu installeres på vandsteder, der er mistænkt for forurening med legionella-bakterier. Enheden lover mere pålidelige resul -
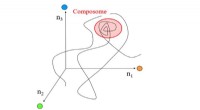 En århundrede gammel model for livets oprindelse får betydelig underbyggelseEn vandring i sammensætningsrum for en lipidverden molekylær samling, vist i forenklede 3 dimensioner. Et punkt på linjen betegner en bestemt sammensætning langs tidsaksen, hvorved de tre koordinater
En århundrede gammel model for livets oprindelse får betydelig underbyggelseEn vandring i sammensætningsrum for en lipidverden molekylær samling, vist i forenklede 3 dimensioner. Et punkt på linjen betegner en bestemt sammensætning langs tidsaksen, hvorved de tre koordinater
- I henhold til den ideelle gasudvikling, hvis trykket er dobbelt initial, hvad sker der volumenet?
- Hvad er dekarbonisering, og hvordan får vi det til at ske?
- Ny selvsamlingsmetode skaber bioelektronik ud af mikroskopiske strukturer
- Forskere tilbyder ny teori om Venus-figurer
- Strategisk formulering af almindelig cement kan have stor indflydelse på vandrensning
- En kombination af Kinas klimapolitik og standarder for køretøjsemissioner kan give en til to kræf…


