Hvorfor har faste stoffer en bestemt form, mens væsker flyder ned ad bakke, og gasser bevæger sig gennem deres containere?
* faste stoffer: I faste stoffer er molekyler tæt pakket sammen og holdes på plads af stærke intermolekylære kræfter. Disse kræfter skaber en stiv struktur, hvilket får faste stoffer til at opretholde en bestemt form og volumen. Molekylerne kan kun vibrere i deres faste positioner.
* væsker: Væsker har svagere intermolekylære kræfter end faste stoffer. Mens molekyler stadig er relativt tæt sammen, har de mere frihed til at bevæge sig rundt. De kan glide forbi hinanden og give væsker deres evne til at flyde. De har formen på deres beholder, men opretholder et bestemt volumen.
* Gasser: Gasser har de svageste intermolekylære kræfter. Molekylerne er langt fra hinanden og bevæger sig frit og sprænger hinanden og beholdervæggene. Dette resulterer i, at gasser spreder sig for at fylde hele deres beholder og påtager sig både formen og volumenet på beholderen.
her er en simpel analogi:
* faste stoffer: Forestil dig et pakket dansegulv, hvor alle holder hænderne og kun kan svinge på plads.
* væsker: Tænk på mennesker i en overfyldt metrobil, der er i stand til at bevæge sig rundt, men stadig tæt sammen.
* Gasser: Forestil dig en flokk fugle, der skyhøje på himlen, fri til at flyve i enhver retning og fylde hele rummet.
Kortfattet: Forskellen i opførsel af faste stoffer, væsker og gasser skyldes styrken af kræfterne, der holder deres molekyler sammen. Jo stærkere kræfterne er, jo mindre frihed er molekylerne nødt til at bevæge sig rundt, hvilket resulterer i en mere stiv struktur.
Sidste artikelHvad er ladningen af lithium og ilt?
Næste artikelHvad sker der med massen af 2 stof, når blandet danner en løsning?
 Varme artikler
Varme artikler
-
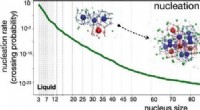 Hastighedsforudsigelse for homogen kernedannelse af methanhydratKredit:HIMS Metanhydrater er den største enkeltkilde til fossilt brændstof på planeten jorden og spiller en rolle i klimaændringer. Den molekylære proces af deres dannelse er ikke kendt og stærkt
Hastighedsforudsigelse for homogen kernedannelse af methanhydratKredit:HIMS Metanhydrater er den største enkeltkilde til fossilt brændstof på planeten jorden og spiller en rolle i klimaændringer. Den molekylære proces af deres dannelse er ikke kendt og stærkt -
 Laserskrivning kan muliggøre elektronisk næse til multigassensorAlexander Castonguay (til venstre), kandidatstuderende i laboratoriet for adjunkt Lauren Zarzar, og adjunkt Huanyu Larry Cheng brugte denne laseropsætning til deres tværfaglige samarbejde. Kredit:Kelb
Laserskrivning kan muliggøre elektronisk næse til multigassensorAlexander Castonguay (til venstre), kandidatstuderende i laboratoriet for adjunkt Lauren Zarzar, og adjunkt Huanyu Larry Cheng brugte denne laseropsætning til deres tværfaglige samarbejde. Kredit:Kelb -
 Raman-spektroskopi giver ikke-invasiv måde at spore celleprogrammering påFigur 1:Raman -spektroskopi bruger laserlys til at karakterisere den kemiske sammensætning af prøver. RIKEN -forskere har nu brugt Raman -spektroskopi til at spore de kemiske ændringer, der sker, når
Raman-spektroskopi giver ikke-invasiv måde at spore celleprogrammering påFigur 1:Raman -spektroskopi bruger laserlys til at karakterisere den kemiske sammensætning af prøver. RIKEN -forskere har nu brugt Raman -spektroskopi til at spore de kemiske ændringer, der sker, når -
 Blaffere hindrer medicins holdbarhedKredit:Jeffrey Chase Hvorfor nogle biofarmaceutiske midler har længere holdbarhed end andre, er et problem, der har forvirret både videnskabsmænd og producenter. Selv den samme medicin, produceret
Blaffere hindrer medicins holdbarhedKredit:Jeffrey Chase Hvorfor nogle biofarmaceutiske midler har længere holdbarhed end andre, er et problem, der har forvirret både videnskabsmænd og producenter. Selv den samme medicin, produceret
- Hvordan man bruger sammenfiltring til langdistance- eller frirumkvantekommunikation
- Gammelt kampingvinfossil fundet i New Zealand
- Genetisk undersøgelse af udødelige vandmænd kan hjælpe med at forklare dens levetid
- Pirarucu:Amazonas gigantiske fisk
- Forskere udvikler miljøsikre, frostbestandige belægninger
- Køkkensvamp superkondensator har mange porøse fordele


