Hvad er en måde at bestemme graden af mætning, som en solid flydende opløsningsfald krystalløses i, hvis der sidder i bunden container er?
Her er hvorfor:
* kvalitativ vs. kvantitativ: Denne metode fortæller dig *, hvis * opløsningen er mættet (hvis det faste sæt) eller umættede (hvis den opløses). Det fortæller dig ikke *, hvor * mættet løsningen er.
* opløselighedsafhængighed: Opløselighed af et fast stof i en væske påvirkes af faktorer som temperatur, tryk og den specifikke karakter af opløsningsmiddel og opløsningsmiddel. Bare det at observere, om de faste sæt ikke tegner sig for disse variabler.
En bedre tilgang:
For at bestemme graden af mætning har du brug for en mere kvantitativ metode. Her er nogle almindelige teknikker:
1. opløselighedstabeller/grafer: Slå op opløseligheden af dit specifikke opløst stof i dit specifikke opløsningsmiddel ved den relevante temperatur. Dette fortæller dig den maksimale mængde opløst stof, der kan opløses pr. Opløsningsmiddel.
2. titrering: Dette involverer gradvist tilsætning af en opløsning af kendt koncentration (titrant) til en opløsning af ukendt koncentration (analyt), indtil et specifikt reaktionens endepunkt er nået. Dette kan bruges til at bestemme koncentrationen af opløsningen i den originale opløsning.
3. spektrofotometri: Denne teknik måler absorbansen af lys ved en opløsning, som kan relateres til koncentrationen af opløstelsen.
Eksempel:
Lad os sige, at du prøver at bestemme graden af mætning af en sukkeropløsning. Du tilsætter en skefuld sukker, og den opløses. Dette fortæller dig, at løsningen er umættet. Du ved dog ikke, hvor meget mere sukker du kan tilføje, før det bliver mættet.
For at bestemme graden af mætning kan du bruge en opløselighedstabel til at slå den maksimale mængde sukker op, der opløses i vand ved stuetemperatur. Dette ville give dig et kvantitativt mål for, hvor meget sukker der stadig kunne opløses i opløsningen.
Kortfattet: Selvom tilføjelse af et fast stof til en løsning kan give dig en grundlæggende forståelse af dens mætning, kræver en mere præcis tilgang kvantitative metoder som opløselighedstabeller, titrering eller spektrofotometri.
 Varme artikler
Varme artikler
-
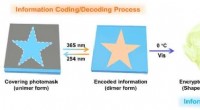 Ny fluorescerende organohydrogel foreslået for at opnå dobbelt informationskrypteringInformationskodning/dekodning og kryptering/dekryptering baseret på den fluorescerende organohydrogel. Kredit:NIMTE Smart Polymer Materials Group ledet af prof. Chen Tao ved Ningbo Institute of Mat
Ny fluorescerende organohydrogel foreslået for at opnå dobbelt informationskrypteringInformationskodning/dekodning og kryptering/dekryptering baseret på den fluorescerende organohydrogel. Kredit:NIMTE Smart Polymer Materials Group ledet af prof. Chen Tao ved Ningbo Institute of Mat -
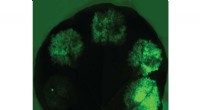 Nye syntetiske biologiværktøjer låser op for kompleks anlægsteknikEt blad med forskellige syntetiske promotorer, der udtrykker grønt fluorescerende protein, demonstrerer rækken af ekspressionsniveauer, der kan opnås med deres konstruerede promotorer. Kredit:JBEI/B
Nye syntetiske biologiværktøjer låser op for kompleks anlægsteknikEt blad med forskellige syntetiske promotorer, der udtrykker grønt fluorescerende protein, demonstrerer rækken af ekspressionsniveauer, der kan opnås med deres konstruerede promotorer. Kredit:JBEI/B -
 Ny metode eliminerer interferens af nikotin ved påvisning af metamfetaminIonmobilitetsspektre for metamfetamin, nikotin, og deres blanding uden (venstre) og med dopet pyridin (højre). Kredit:XIA Lei For nylig, en forskergruppe ledet af Chu Yannan og Huang Chaoqun fra I
Ny metode eliminerer interferens af nikotin ved påvisning af metamfetaminIonmobilitetsspektre for metamfetamin, nikotin, og deres blanding uden (venstre) og med dopet pyridin (højre). Kredit:XIA Lei For nylig, en forskergruppe ledet af Chu Yannan og Huang Chaoqun fra I -
 Ingeniører gør mikrofluidik modulopbygget ved hjælp af de populære sammenlåsende blokkeMIT -forskere har udviklet en ny platform for mikrofluidik, ved hjælp af LEGO klodser. Vist her, væske strømmer gennem bittesmå kanaler fræset ind i sidevæggene på LEGO klodser. Kredit:Massachusetts I
Ingeniører gør mikrofluidik modulopbygget ved hjælp af de populære sammenlåsende blokkeMIT -forskere har udviklet en ny platform for mikrofluidik, ved hjælp af LEGO klodser. Vist her, væske strømmer gennem bittesmå kanaler fræset ind i sidevæggene på LEGO klodser. Kredit:Massachusetts I
- Panamakanalen afværger en krise for nu - men det koster drikkevandet
- Hvordan vi ser bedre ved at 'kigge væk'
- Hvilken stjerne er større neutron- eller subgant stjerne?
- Meget afventer stadig, hvordan højsøsanktioner vil virke
- Hvorfor er saltvand sværere end vand?
- Hvilken type jord har planeten Neptune?


