Hvordan er opløselighed relateret til temperatur?
Generelle tendenser:
* faste stoffer: For de fleste faste opløste stoffer stiger opløselighed med stigende temperatur . Dette skyldes, at øget termisk energi tillader opløsningspartiklerne at overvinde de attraktive kræfter, der holder dem i fast tilstand, så de kan bryde fri og opløses.
* Gasser: For de fleste gasformige opløste stoffer falder opløselighed med stigende temperatur . Dette skyldes, at gasmolekyler ved højere temperaturer har mere kinetisk energi og er mere tilbøjelige til at flygte fra den flydende opløsning i den omgivende atmosfære.
Undtagelser:
* Nogle faste stoffer udviser et fald i opløselighed med stigende temperatur. Dette sker, når opløsningsprocessen er eksoterm (frigiver varme). I disse tilfælde skifter stigende temperatur ligevægten mod dannelsen af uopløst fast stof.
* Nogle gasser viser en stigning i opløselighed med stigende temperatur. Dette sker, når opløsningsprocessen er endotermisk (absorberer varme). Stigningen i temperatur favoriserer opløsningsprocessen, hvilket fører til en højere opløselighed.
faktorer, der påvirker forholdet:
* arten af opløst stof og opløsningsmiddel: De specifikke egenskaber ved opløst stof og opløsningsmiddel spiller en betydelig rolle i bestemmelsen af opløselighedsadfærd.
* tryk: For gasser kan tryk væsentligt påvirke opløseligheden. Højere tryk fører til højere opløselighed.
* Polaritet: Opløsninger har en tendens til at opløses bedre i opløsningsmidler med lignende polariteter.
Forståelse af forholdet:
For at forstå forholdet mellem opløselighed og temperatur er det vigtigt at overveje entalpiændringen (ΔH) af opløsning .
* eksoterme opløsning (ΔH <0): Opløsningsprocessen frigiver varme. Forøgelse af temperaturen skifter ligevægten mod dannelsen af uopløst fast stof, hvilket resulterer i et fald i opløselighed.
* endotermisk opløsning (ΔH> 0): Opløsningsprocessen absorberer varmen. Forøgelse af temperaturen skifter ligevægten mod dannelsen af opløst opløst stof, hvilket resulterer i en stigning i opløselighed.
Kortfattet:
Mens der er generelle tendenser, kan forholdet mellem opløselighed og temperatur være komplekst og variere afhængigt af det specifikke stof, der opløses. At forstå enthalpiændringen af opløsning kan hjælpe med at forudsige ændringsretningen i opløselighed med temperatur.
 Varme artikler
Varme artikler
-
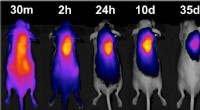 Et hyppelys for kemoterapilægemidlerHos mus, en hydrogel rekrutterer et farvestoffemærket molekyle (farvede områder) til sin placering, viser dets potentiale til at være et hjemfyrtårn for kræftmedicin. Kredit:Tilpasset fra ACS Central
Et hyppelys for kemoterapilægemidlerHos mus, en hydrogel rekrutterer et farvestoffemærket molekyle (farvede områder) til sin placering, viser dets potentiale til at være et hjemfyrtårn for kræftmedicin. Kredit:Tilpasset fra ACS Central -
 Supersmøreevne i mikroskala kan bane vejen for fremtidige forbedrede elektromekaniske enhederKredit:CC0 Public Domain Smøreevne måler reduktionen i mekanisk friktion og slid af et smøremiddel. Disse er hovedårsagerne til komponentfejl og energitab i mekaniske og elektromekaniske systemer.
Supersmøreevne i mikroskala kan bane vejen for fremtidige forbedrede elektromekaniske enhederKredit:CC0 Public Domain Smøreevne måler reduktionen i mekanisk friktion og slid af et smøremiddel. Disse er hovedårsagerne til komponentfejl og energitab i mekaniske og elektromekaniske systemer. -
 Forskere udvikler hybrid meta-biomateriale, der kan forlænge levetiden af hofteimplantater3D-printet hofteimplantat udviklet ved hjælp af det nye hybride meta-biomateriale. Kredit:TU Delft Et hybrid meta-biomateriale, der fremmer knoglevækst, er ikke noget, du finder i naturen, men det
Forskere udvikler hybrid meta-biomateriale, der kan forlænge levetiden af hofteimplantater3D-printet hofteimplantat udviklet ved hjælp af det nye hybride meta-biomateriale. Kredit:TU Delft Et hybrid meta-biomateriale, der fremmer knoglevækst, er ikke noget, du finder i naturen, men det -
 Et katalytisk støttemateriale spiller en ledende rolleArgonne-kemikere har afsløret en vigtig og uventet reaktionsmekanisme - kaldet redox-adfærd - på overfladen af katalysatorbærematerialer. Disse materialer er lovende katalytiske materialer i sig sel
Et katalytisk støttemateriale spiller en ledende rolleArgonne-kemikere har afsløret en vigtig og uventet reaktionsmekanisme - kaldet redox-adfærd - på overfladen af katalysatorbærematerialer. Disse materialer er lovende katalytiske materialer i sig sel
- Skoleprojekter om, hvordan man laver en olie Rig
- Fysikere simulerer motorolieadfærd under ekstremt tryk
- Hydraulisk brud påvirker spædbørns sundhed negativt
- Retssag:Asbest, skimmel, dampe gør brandstationen farlig
- Nyt billedværktøj visualiserer cellefunktioner i et mikrofysiologisk system
- Et vakuum ultraviolet fotoionisering-time-of-flight massespektrometer til analyse af gasfase radikal…


