Sgerer kogepunktet for en væske stigninger eller forbliver det samme, hvis den intermolekylære kraft øges?
* Intermolekylære kræfter (IMFS) er de attraktive kræfter mellem molekyler. Stærkere IMF'er gennemsnitlige molekyler holdes tættere sammen.
* kogepunkt er den temperatur, hvormed en væske ændrer sig til en gas. For en væske at koge, har dens molekyler brug for nok energi til at overvinde IMF'erne, der holder dem sammen og undslipper i gasfasen.
* stærkere IMF'er kræver mere energi til at bryde. Dette betyder, at der er behov for en højere temperatur (kogepunkt) for at tilvejebringe nok energi til, at molekylerne kan fordampe.
Eksempel:
* Vand har stærke brintbindinger, en type IMF. Dette er grunden til, at vand har et relativt højt kogepunkt sammenlignet med andre væsker som metan, som har svagere London -spredningskræfter.
Kortfattet: Jo stærkere de intermolekylære kræfter, jo mere energi kræves for at overvinde dem, hvilket resulterer i et højere kogepunkt.
Sidste artikelHvad er de vigtigste anvendelser af fossile brændstoffer?
Næste artikelHvad er de seks ioner i havvand?
 Varme artikler
Varme artikler
-
 Modellering af evigheden i stenlaboratorietUdforskningstunnel i Mont Terri internationale stenlaboratorium. Siden 1996, klippeformationer, der kunne spille en rolle i opbevaring af radioaktivt affald, er blevet undersøgt her. Kredit:BGR Nå
Modellering af evigheden i stenlaboratorietUdforskningstunnel i Mont Terri internationale stenlaboratorium. Siden 1996, klippeformationer, der kunne spille en rolle i opbevaring af radioaktivt affald, er blevet undersøgt her. Kredit:BGR Nå -
 Højtydende elektrokatalysatorer til at drive udviklingen af direkte ethanolbrændselscellerKombinerer kerne-skal-konstruktion med en legeringseffekt for at øge palladiums katalytiske ydeevne i ethanoloxidationsreaktioner. Kredit:YANG Jun Forskere fra Institute of Process Engineering (IP
Højtydende elektrokatalysatorer til at drive udviklingen af direkte ethanolbrændselscellerKombinerer kerne-skal-konstruktion med en legeringseffekt for at øge palladiums katalytiske ydeevne i ethanoloxidationsreaktioner. Kredit:YANG Jun Forskere fra Institute of Process Engineering (IP -
 Aktivering af kulstof-fluorbindinger via samarbejde mellem en fotokatalysator og tinVerdens første regioselektive C-F-bindingstransformation af perfluorerede forbindelser. Kredit:Osaka University Fluorerede forbindelser er en vigtig gruppe af forbindelser, der er meget udbredt i
Aktivering af kulstof-fluorbindinger via samarbejde mellem en fotokatalysator og tinVerdens første regioselektive C-F-bindingstransformation af perfluorerede forbindelser. Kredit:Osaka University Fluorerede forbindelser er en vigtig gruppe af forbindelser, der er meget udbredt i -
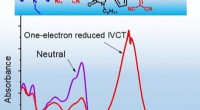 Tændt for IR-aktive organiske pigmenterKredit:Wiley I fotosyntese og organisk solcelle, pigmentmolekyler omdanner lys til elektrisk ladning. Et team af kemikere har nu produceret et usædvanligt organisk pigment, som tændes af en elektr
Tændt for IR-aktive organiske pigmenterKredit:Wiley I fotosyntese og organisk solcelle, pigmentmolekyler omdanner lys til elektrisk ladning. Et team af kemikere har nu produceret et usædvanligt organisk pigment, som tændes af en elektr
- Hvorfor prøver forskere at lave nye elementer?
- Mærkelige kroppe, Hurtige spin holder kosmiske ringe tæt
- Hvor kan jeg finde information om videnskabseksperimenter?
- Undersøgelse viser, hvor alvorligt investorer tog muligheden for en demokratisk revolution under Eg…
- Er natriumborhydrid surt eller basisk?
- Dyr, der hylder på natten


