Hvorfor kan du komprimere en gas, men ikke flydende eller fast?
Kompressibilitet og tilstande af stof
* Gasser: Gasmolekyler er langt fra hinanden og bevæger sig frit. De har svage intermolekylære kræfter, så anvendelse af tryk kan let skubbe dem tættere sammen, hvilket reducerer volumenet.
* væsker: Flydende molekyler er tættere sammen end gasmolekyler og har stærkere intermolekylære kræfter. Mens de kan komprimeres, kræver det markant mere tryk end at komprimere en gas.
* faste stoffer: Faste molekyler er tæt pakket og har de stærkeste intermolekylære kræfter. Komprimering af et fast stof kræver enormt pres for at tvinge molekylerne tættere sammen, og selv da er ændringen i volumen normalt meget lille.
Tænk på det på denne måde:
* gas: Forestil dig et værelse fuld af balloner. Det er let at presse dem tættere sammen.
* væske: Forestil dig en spand fuld af vand. Det er sværere at skubbe vandmolekylerne tættere sammen, men det er stadig muligt.
* fast: Forestil dig en mursten. Du kan ikke nemt presse det ind i et mindre rum uden at bryde det.
Undtagelser:
Der er undtagelser fra denne generelle regel. Nogle materialer, som vand, har en unik opførsel, hvor deres solide form (is) faktisk er mindre tæt end dens flydende form. Dette er grunden til, at is flyder.
Kortfattet:
Mens gasser er de mest komprimerbare, kan væsker og faste stoffer også komprimeres, omend i mindre grad. Forskellen ligger i afstand og interaktioner mellem molekyler, som bestemmer, hvor let de kan skubbes tættere sammen.
 Varme artikler
Varme artikler
-
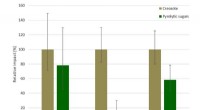 Bæredygtighed af nyt creosotalternativ bekræftetKredit:BTG Biomass Technology Group En nylig offentliggjort undersøgelse har bekræftet bæredygtighedsoplysningerne for et nyt biobaseret alternativ til creosot, der er ved at blive udviklet i Bio4
Bæredygtighed af nyt creosotalternativ bekræftetKredit:BTG Biomass Technology Group En nylig offentliggjort undersøgelse har bekræftet bæredygtighedsoplysningerne for et nyt biobaseret alternativ til creosot, der er ved at blive udviklet i Bio4 -
 Krystallisation afklaret, rapporterer forskereProfessor Qian Chen, siddende, og kandidatstuderende Binbin Luo, venstre, og Zihao Ou samarbejdede med forskere ved Northwestern University for at observere og simulere dannelsen af krystallinske ma
Krystallisation afklaret, rapporterer forskereProfessor Qian Chen, siddende, og kandidatstuderende Binbin Luo, venstre, og Zihao Ou samarbejdede med forskere ved Northwestern University for at observere og simulere dannelsen af krystallinske ma -
 LSU Chemical Engineering afslører nye destillationskolonnerJohn Pendergast, professional-in-residence i Cain Department of Chemical Engineering, og John Flake, formand for Cain Department of Chemical Engineering. Kredit:LSU College of Engineering LSU Cain
LSU Chemical Engineering afslører nye destillationskolonnerJohn Pendergast, professional-in-residence i Cain Department of Chemical Engineering, og John Flake, formand for Cain Department of Chemical Engineering. Kredit:LSU College of Engineering LSU Cain -
 Mere sund mælkechokolade ved at tilføje jordnødder, kaffespildKredit:CC0 Public Domain Mælkechokolade er en forbrugerfavorit verden over, værdsat for sin søde smag og cremede tekstur. Denne konfekt kan findes i alle typer godbidder, men det er ikke ligefrem
Mere sund mælkechokolade ved at tilføje jordnødder, kaffespildKredit:CC0 Public Domain Mælkechokolade er en forbrugerfavorit verden over, værdsat for sin søde smag og cremede tekstur. Denne konfekt kan findes i alle typer godbidder, men det er ikke ligefrem
- Martian Moons Exploration rumfartøj til at tage ultra-high definition billeder af Mars via 8K kamer…
- NIST lancerer et dramatisk forbedret system til måling af lysets intensitet og spektrum
- Børn er vores fremtid, og planetens. Sådan kan du lære dem at tage sig af det
- Azeotropisk blanding af saltsyre og vand?
- Forhistoriske mennesker har sandsynligvis dannet parringsnetværk for at undgå indavl
- Stagedykning med biomolekyler forbedrer optisk mikroskopi


