Hvordan passer opløsnings- og opløsningsmiddelpartikler sammen?
1. Polære opløste stoffer og polære opløsningsmidler (som opløses som)
* Eksempel: Sukker (opløst) opløst i vand (opløsningsmiddel)
* interaktion: Polære molekyler har ujævn ladningsfordeling, hvilket skaber positive og negative formål. Vand er meget polært med et stærkt dipolmoment. Sukkermolekyler har polære hydroxylgrupper (-OH). Disse modsatte ladninger tiltrækker og danner hydrogenbindinger mellem opløst og opløsningsmiddel.
* fit: De polære opløsningsmiddel- og opløsningsmiddelmolekyler justeres med positive ender af et molekyle, der tiltrækker negative ender af en anden. Dette skaber en stærk attraktion og tillader, at opløste partikler spredes jævnt i opløsningsmidlet.
2. Ikke -polære opløste stoffer og ikke -polære opløsningsmidler (som opløser som)
* Eksempel: Olie (opløst) opløst i benzin (opløsningsmiddel)
* interaktion: Ikke -polære molekyler har en ensartet ladningsfordeling. De interagerer hovedsageligt gennem svage van der Waals Forces (London Dispersion Forces).
* fit: De ikke -polære opløste stof- og opløsningsmiddelmolekyler kan let blandes, fordi de deler lignende intermolekylære kræfter. Molekylerne danner ikke stærke bindinger, men de er i stand til at blande sig på grund af deres lignende attraktion og frastødelsesegenskaber.
3. Ioniske opløste stoffer og polære opløsningsmidler
* Eksempel: Salt (NaCl) opløst i vand
* interaktion: Ioniske forbindelser er sammensat af ladede ioner (kationer og anioner). Polære opløsningsmidler som vand har stærke dipolmomenter og kan tiltrække og omringe ionerne, trække dem fra hinanden og adskille dem fra krystalgitteret. Denne proces kaldes hydrering.
* fit: De positive ender af vandmolekyler omgiver anionerne, og de negative ender af vandmolekyler omgiver kationerne. Den stærke tiltrækning mellem ioner og de polære vandmolekyler gør det muligt for den ioniske forbindelse at opløses.
4. Undtagelser og mere komplekse sager
* opløselighed: I hvilket omfang et opløst stof opløses i et opløsningsmiddel afhænger af styrken af interaktioner mellem opløsningsmiddel- og opløsningsmiddelmolekylerne. Nogle gange kan en lille mængde af et ikke -polært opløst stof opløses i et polært opløsningsmiddel på grund af svage interaktioner.
* komplekse molekyler: Større molekyler med flere funktionelle grupper kan have både polære og ikke -polære regioner. Deres opløselighed bestemmes af balancen mellem disse interaktioner.
Kortfattet:
Den måde, opløste og opløsningsmiddelpartikler passer sammen, afhænger af deres polaritet og den type intermolekylære kræfter, de udviser. "Ligesom opløser som" er en generel tommelfingerregel:polære opløste stoffer opløses godt i polære opløsningsmidler, og ikke -polære opløste stoffer opløses godt i ikke -polære opløsningsmidler. Ioniske opløste stoffer opløses ofte i polære opløsningsmidler gennem stærke ion-dipol-interaktioner.
Sidste artikelEr kridt en isolator eller dirigent?
Næste artikelHvordan kan kuldioxid opsamles?
 Varme artikler
Varme artikler
-
 Team udvikler robust molekylær propel til ensrettede rotationerEt kig på hvordan propellen er sammensat og de ensrettede rotationer. Kredit:Saw-Wai Hla Et team af forskere fra Ohio University, Argonne National Laboratory, Universitié de Toulouse i Frankrig og
Team udvikler robust molekylær propel til ensrettede rotationerEt kig på hvordan propellen er sammensat og de ensrettede rotationer. Kredit:Saw-Wai Hla Et team af forskere fra Ohio University, Argonne National Laboratory, Universitié de Toulouse i Frankrig og -
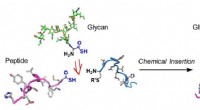 En vindende kombination til glykoproteinsynteseGlycoproteinsyntese ved kemisk indsættelse ved hjælp af en thiosyremedieret strategi:Metoden samler et fuldt glycoproteinsegment i to trin. Kredit:Osaka University Mange processer i kroppen regule
En vindende kombination til glykoproteinsynteseGlycoproteinsyntese ved kemisk indsættelse ved hjælp af en thiosyremedieret strategi:Metoden samler et fuldt glycoproteinsegment i to trin. Kredit:Osaka University Mange processer i kroppen regule -
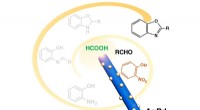 Forskere udvikler miljøvenlige, 4-i-1 katalysatorKatalysatorer som denne nye udviklet på Brown University kan muligvis hjælpe med at gøre industriel kemi mere bæredygtig. Kredit:Sun Lab / Seto Lab / Brown University Brown University-forskere har
Forskere udvikler miljøvenlige, 4-i-1 katalysatorKatalysatorer som denne nye udviklet på Brown University kan muligvis hjælpe med at gøre industriel kemi mere bæredygtig. Kredit:Sun Lab / Seto Lab / Brown University Brown University-forskere har -
 Forskere opdager forbindelser, der kunne have været med til at starte liv på JordenFosforatomer i gult, iltatomer indblandet. Kredit:Britvin et al / Geology, 2020 Fosfor er et element, der er afgørende for livet. Det er grundlæggende for alle levende organismer, og er en nøgleko
Forskere opdager forbindelser, der kunne have været med til at starte liv på JordenFosforatomer i gult, iltatomer indblandet. Kredit:Britvin et al / Geology, 2020 Fosfor er et element, der er afgørende for livet. Det er grundlæggende for alle levende organismer, og er en nøgleko
- 3-D-print og månestøv:Et astronautsæt til fremtidig rumudforskning?
- Sådan beregnes en 3D Perimeter
- At se gennem vægge af ukendte materialer
- Video:Er ammoniakmotorer fremtidens vej?
- Højtemperaturenheder fremstillet af film, der bøjer, når de trækker vejret
- Ny teknologi kan udrydde bakterier i vedvarende sår


