Hvis jeg opløser 50 gram salt i 1000 ml vand, og temperaturen falder fra 30,5 DEGC til 35,6 Hvad er varmeændringsentalpi -reaktion var dette en eksoterm eller endoterm?
Her er hvorfor:
* Opløsning af salt (NaCl) i vand er normalt en endotermisk proces. Dette betyder, at varme absorberes fra omgivelserne, hvilket får temperaturen på opløsningen til at falde.
* Temperatur kan ikke falde og øges derefter samtidig. Hvis temperaturen faldt fra 30,5 ° C, kunne den ikke derefter stige til 35,6 ° C inden for den samme proces.
For at beregne entalpiændringen (ΔH) af reaktionen har vi brug for den korrekte temperaturændring.
Sådan nærmer vi os beregningen, hvis vi havde de korrekte temperaturdata:
1. Beregn ændringen i temperatur (ΔT): ΔT =endelig temperatur - starttemperatur
2. Bestem massen af løsningen: Da vandtætheden er ca. 1 g/ml, er massen på 1000 ml vand 1000 g. Tilsæt massen af saltet (50 g) for at få den samlede masse af opløsningen (1050 g).
3. Brug den specifikke varmekapacitet af vand: Vandets specifikke varmekapacitet er ca. 4.184 J/g ° C.
4. Beregn varmeændringen (Q): Q =masse af opløsning × specifik varmekapacitet × ΔT
5. Forhold varmeændring til entalpiændring: Da processen er ved konstant tryk, er varmeændringen (Q) lig med entalpiændringen (ΔH) af reaktionen.
Husk: Hvis den endelige temperatur er lavere end den indledende temperatur, vil entalpiændringen (ΔH) være positiv, hvilket indikerer en endotermisk reaktion. Hvis den endelige temperatur er højere, vil entalpiændringen være negativ, hvilket indikerer en eksoterm reaktion.
 Varme artikler
Varme artikler
-
 Forskere opfinder lim aktiveret af magnetfelt(Venstre til højre) NTU Assoc Prof Terry Steele, Prof Raju V. Ramanujan og Dr. Richa Chaudhary holder forskellige bløde og hårde materialer, der er bundet af deres nye magnethærdende lim, kredit:NTU S
Forskere opfinder lim aktiveret af magnetfelt(Venstre til højre) NTU Assoc Prof Terry Steele, Prof Raju V. Ramanujan og Dr. Richa Chaudhary holder forskellige bløde og hårde materialer, der er bundet af deres nye magnethærdende lim, kredit:NTU S -
 Undersøgelsen stiller spørgsmålstegn ved blyforgiftningens rolle i Franklin Expeditions dødsfaldI sommeren 1845 under kommando af Sir John Franklin, 128 officerer og besætning ombord på skibene HMS Erebus, over, og HMS Terror kom ind i farvandene i det arktiske Nordamerika med det mål at fuldfør
Undersøgelsen stiller spørgsmålstegn ved blyforgiftningens rolle i Franklin Expeditions dødsfaldI sommeren 1845 under kommando af Sir John Franklin, 128 officerer og besætning ombord på skibene HMS Erebus, over, og HMS Terror kom ind i farvandene i det arktiske Nordamerika med det mål at fuldfør -
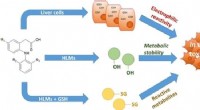 Subtile ændringer i kemisk struktur kan påvirke lægemiddeltoksicitetDerivater af lumiracoxib blev syntetiseret for at forstå forskellige kemiske gruppers bidrag til toksicitet. Forbindelserne blev testet i humane leverceller, og også med og uden tilstedeværelse af glu
Subtile ændringer i kemisk struktur kan påvirke lægemiddeltoksicitetDerivater af lumiracoxib blev syntetiseret for at forstå forskellige kemiske gruppers bidrag til toksicitet. Forbindelserne blev testet i humane leverceller, og også med og uden tilstedeværelse af glu -
 Flydende krystallers overraskende styrkeForskere er et skridt tættere på at udvikle længerevarende og sikrere batterier ved hjælp af flydende krystaller. Kredit:Pixabay Dendritter er de ødelæggende biprodukter af cyklussen med opladning
Flydende krystallers overraskende styrkeForskere er et skridt tættere på at udvikle længerevarende og sikrere batterier ved hjælp af flydende krystaller. Kredit:Pixabay Dendritter er de ødelæggende biprodukter af cyklussen med opladning
- Vellykket opsendelse af eROSITA røntgenteleskop
- Massiv exoplanet opdaget ved hjælp af gravitationel mikrolinsemetode
- Celler tilpasser sig ultrahurtigt til nul tyngdekraft
- Hvordan ville digitale COVID-vaccinepas fungere? Og hvad forhindrer folk i at forfalske dem?
- Snesevis af ultrakompakte dværggalakser opdaget
- Sådan får du en pære til at arbejde med et batteri


