Hvilke effekter har koncentrationen af reaktanter på hastighedsreaktion?
Generelt princip:
* Højere koncentration =hurtigere reaktion: Jo flere molekyler af reaktanter er til stede i et givet volumen, jo hyppigere kolliderer de med hinanden. Disse kollisioner er vigtige for, at kemiske reaktioner kan forekomme.
detaljer:
* Kollisionsteori: Denne teori forklarer, at reaktioner sker, når reaktantmolekyler kolliderer med tilstrækkelig energi og den korrekte orientering. Forøgelse af koncentrationen øger hyppigheden af disse effektive kollisioner, hvilket fører til en hurtigere reaktionshastighed.
* rate lov: Hastighedsloven for en reaktion udtrykker forholdet mellem reaktionshastigheden og koncentrationen af reaktanter. For eksempel kan en simpel rentelov se ud:
* hastighed =k [a]^m [b]^n
* Hvor:
* k =hastighedskonstant (en konstant for en bestemt reaktion)
* [A], [B] =koncentrationer af reaktanter A og B
* m, n =reaktionsordrer (typisk bestemt eksperimentelt)
* Højere værdier for M og N indikerer større afhængighed af reaktionshastigheden af koncentrationen af de respektive reaktanter.
Eksempler:
* brændende et stykke papir: Et lille stykke papir brænder langsomt, fordi der er mindre overfladeareal udsat for ilt. Et krøllet stykke brænder hurtigere, fordi det øgede overfladeareal udsætter mere papir for ilt, hvilket fører til flere kollisioner og en hurtigere reaktion.
* opløste sukker i vand: Sukker opløses hurtigere i varmt vand, fordi den højere temperatur øger den kinetiske energi i vandmolekyler, hvilket får dem til at kollidere med sukkermolekylerne oftere. Dette fører til hurtigere opløsning.
Vigtige overvejelser:
* reaktionsordre: Det specifikke forhold mellem koncentration og hastighed afhænger af reaktionsordren. En reaktion kan være første orden, anden orden eller endda nul-orden med hensyn til en bestemt reaktant.
* ligevægt: Mens stigende koncentration generelt øger en reaktionshastighed, ændrer den ikke ligevægtskonstanten (K). Ligevægt henviser til den tilstand, hvor hastighederne for de fremadgående og omvendte reaktioner er ens.
* katalysatorer: Katalysatorer fremskynder reaktioner uden at blive konsumeret i processen. De arbejder ved at tilvejebringe en alternativ vej med en lavere aktiveringsenergi, som ikke nødvendigvis afhænger af koncentrationen.
Kortfattet: Koncentrationen af reaktanter er en afgørende faktor, der påvirker hastigheden for en kemisk reaktion. Højere koncentration fører til hyppigere kollisioner mellem reaktantmolekyler, hvilket resulterer i en hurtigere reaktion. Det specifikke forhold mellem koncentration og hastighed defineres af reaktionsordren.
 Varme artikler
Varme artikler
-
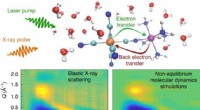 Forskere får indsigt i, hvordan opløsningsmiddelmolekyler påvirker lysdrevne reaktionerAbstrakt. Kredit: Naturkemi (2021). DOI:10.1038/s41557-020-00629-3 Lysabsorberende molekyler kan omdanne fotoner til elektricitet eller brændstoffer ved at skifte elektroner fra et atom til et an
Forskere får indsigt i, hvordan opløsningsmiddelmolekyler påvirker lysdrevne reaktionerAbstrakt. Kredit: Naturkemi (2021). DOI:10.1038/s41557-020-00629-3 Lysabsorberende molekyler kan omdanne fotoner til elektricitet eller brændstoffer ved at skifte elektroner fra et atom til et an -
 Ålegræssyre og resveratrol produceret af cellefabrikker for første gangSom et bevis på konceptet for sulfateringsprocessen i cellefabrikker, forskerne ville producere zosterinsyre. Denne syre findes i marinaplanten ålegræs og er et kraftigt antifoulingmiddel. Kredit:Chri
Ålegræssyre og resveratrol produceret af cellefabrikker for første gangSom et bevis på konceptet for sulfateringsprocessen i cellefabrikker, forskerne ville producere zosterinsyre. Denne syre findes i marinaplanten ålegræs og er et kraftigt antifoulingmiddel. Kredit:Chri -
 Stenåndende bakterier er elektronspindoktorer, viser undersøgelseElektroner, der bevæger sig gennem protein-ledninger mellem bakterieceller og overflader uden for disse celler, har en tendens til at have et bestemt kvantespin. Kredit:Katya Kadyshevskaya Elektro
Stenåndende bakterier er elektronspindoktorer, viser undersøgelseElektroner, der bevæger sig gennem protein-ledninger mellem bakterieceller og overflader uden for disse celler, har en tendens til at have et bestemt kvantespin. Kredit:Katya Kadyshevskaya Elektro -
 Sensor kan hjælpe patienter med at holde styr på deres medicinEn lillebitte, berøringsbaseret sensor bruger sved til at registrere niveauet af lithium i kroppen. Kredit:Jialun Zhu og Shuyu Lin Lithium kan lindre symptomerne på bipolar lidelse og depression -
Sensor kan hjælpe patienter med at holde styr på deres medicinEn lillebitte, berøringsbaseret sensor bruger sved til at registrere niveauet af lithium i kroppen. Kredit:Jialun Zhu og Shuyu Lin Lithium kan lindre symptomerne på bipolar lidelse og depression -
- Mørk turisme er vokset omkring myten om fængselstræ
- Hvilke processer bruges af videnskabsmand, der foretager feltundersøgelser og dem, der udfører udl…
- Ny teknik til måling af drivhusgasproduktion fra optøende permafrost
- Hvilken pyramide repræsenterer mængden af energi eller stof, der findes på hvert niveau af en f…
- Hvad er et eksempel på grå stær i geografi?
- Amerika har sendt fem rovere til Mars - hvornår vil mennesker følge efter?


