Hvorfor tilføje vand til HCL -opløsning?
1. Fortynding:
* Faldende koncentration: Den mest almindelige årsag til tilsætning af vand er at fortynde HCL -opløsningen, hvilket betyder at reducere dens koncentration. Dette gøres ved at øge mængden af opløsningen, mens mængden af HCL konstant holdes konstant. Fortynding bruges til:
* sikkerhed: Koncentreret HCL er meget ætsende og farlig. Fortynding af det gør det mere sikkert at håndtere og bruge.
* specifikke reaktioner: Mange reaktioner kræver en specifik koncentration af HCI, og fortynding giver dig mulighed for at opnå den ønskede koncentration.
* titrering: I titreringer bestemmes koncentrationen af en opløsning ved at reagere den med en opløsning af kendt koncentration. Fortynding bruges ofte til at gøre titrantopløsningen til den passende koncentration.
2. Temperaturkontrol:
* varmefrigivelse: Opløsning af HCL i vand er en eksoterm reaktion, hvilket betyder, at den frigiver varme. Tilsætning af vand langsomt kan hjælpe med at kontrollere temperaturstigningen og forhindre, at opløsningen bliver for varm. Dette er vigtigt for sikkerhed og for at forhindre potentiel skade på glasvarer eller udstyr.
3. Kemiske reaktioner:
* Visse reaktioner: Nogle kemiske reaktioner kræver, at tilstedeværelsen af vand fortsætter. For eksempel kræver visse metalreaktioner med HCI, at vand fungerer som en katalysator.
ting at huske på:
* Tilsæt altid syre til vand, aldrig vand til syre! Dette er en sikkerhedsforanstaltning. Tilsætning af vand til koncentreret syre kan forårsage en voldelig reaktion, potentielt sprøjte syren og forårsage alvorlige forbrændinger.
* den tilsatte vand bestemmer den endelige koncentration. Jo mere vand du tilsætter, jo lavere bliver koncentrationen af HCL.
Eksempel:
Forestil dig, at du har 10 ml koncentreret HCI (37% koncentration) og har brug for en 1% HCI -opløsning til en reaktion. Du bliver nødt til at tilføje en betydelig mængde vand for at fortynde det til den ønskede koncentration.
Fortæl mig, hvis du har en bestemt situation i tankerne, og jeg kan give mere specifik vejledning!
Sidste artikelHvad er de 8 mest almindelige gasser i atmosfæren?
Næste artikelHvorfor kaldes B2O3 Boricoxid?
 Varme artikler
Varme artikler
-
 Granulært aluminium til fremtidige computereDen fluxonium-qubit, der indeholder granulært aluminium, kan forblive i en tilstand mellem 0 og 1 i en tid på op til 30 mikrosekunder (fig. Ioan Pop, SÆT) Computere baseret på kvantemekaniske prin
Granulært aluminium til fremtidige computereDen fluxonium-qubit, der indeholder granulært aluminium, kan forblive i en tilstand mellem 0 og 1 i en tid på op til 30 mikrosekunder (fig. Ioan Pop, SÆT) Computere baseret på kvantemekaniske prin -
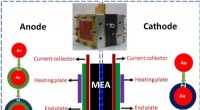 Forskere udvikler selektive elektrokatalysatorer for at øge ydeevnen for brændselsceller i methano…DMFC -samlinger. Skematisk illustration, der viser en DMFC fremstillet med selektive elektrokatalysatorer ved anode- og katodekamrene. Indløb er fotografiet af den samlede celle. Kredit:YANG jun E
Forskere udvikler selektive elektrokatalysatorer for at øge ydeevnen for brændselsceller i methano…DMFC -samlinger. Skematisk illustration, der viser en DMFC fremstillet med selektive elektrokatalysatorer ved anode- og katodekamrene. Indløb er fotografiet af den samlede celle. Kredit:YANG jun E -
 Ætsning af vejen til en brintøkonomi ved hjælp af plasmastrålerEt skridt tættere på en effektiv måde at producere brint på, så vi endelig kan undvære fossile brændstoffer og andre energikilder, der er skadelige for vores planet Kredit:Tokyo University of Science
Ætsning af vejen til en brintøkonomi ved hjælp af plasmastrålerEt skridt tættere på en effektiv måde at producere brint på, så vi endelig kan undvære fossile brændstoffer og andre energikilder, der er skadelige for vores planet Kredit:Tokyo University of Science -
 Hurtig test finder tegn på sepsis i en enkelt dråbe blodUniversity of Illinois forskere og læger på Carle Foundation Hospital udviklede en hurtig test for sepsis, der tæller hvide blodlegemer og proteinmarkører på deres overflade for at overvåge en patient
Hurtig test finder tegn på sepsis i en enkelt dråbe blodUniversity of Illinois forskere og læger på Carle Foundation Hospital udviklede en hurtig test for sepsis, der tæller hvide blodlegemer og proteinmarkører på deres overflade for at overvåge en patient
- Afsløring af hemmelig struktur til sikrere sprængstoffer
- Er det sandt, at temperaturen er målet for gennemsnitlige kinetiske energipartikler i et objekt?
- Virksomheder, der bruger konservative regnskabsprincipper, er mindre tilbøjelige til at blive udsat…
- Sådan fungerer kulstofhandel
- Sådan finder du brudproduktet
- Ny, holdbar katalysator til nøglebrændstofcellereaktion kan vise sig nyttig i miljøvenlige køret…


