Hvad er kogepunktet og frysningen til?
kogepunkt
* Definition: Kogepunktet for et stof er den temperatur, hvormed dets damptryk er lig med det omgivende atmosfæriske tryk, og væsken ændres til en damp. På enklere termer er det den temperatur, hvorpå en væske begynder at blive til en gas.
* faktorer, der påvirker kogepunktet:
* Intermolekylære kræfter: Stærkere intermolekylære kræfter (som hydrogenbinding) kræver mere energi til at bryde fra hinanden, hvilket fører til højere kogepunkter.
* molekylvægt: Tyngre molekyler har generelt højere kogepunkter.
* tryk: Lavere atmosfærisk tryk resulterer i et lavere kogepunkt.
Frysningspunkt
* Definition: Et stofs frysepunkt er den temperatur, hvormed det overgår fra en væske til en fast tilstand. Det er det punkt, hvor de flydende og faste faser er i ligevægt.
* faktorer, der påvirker frysepunktet:
* Intermolekylære kræfter: Stærkere intermolekylære kræfter fører til højere frysepunkter.
* tryk: Stigende tryk øger generelt frysepunktet.
Nøglepunkter
* Frysnings- og kogepunkterne er specifikke for hvert stof. Vand fryser for eksempel ved 0 ° C (32 ° F) og koger ved 100 ° C (212 ° F) ved standard atmosfærisk tryk.
* Frysning og kogning er fysiske ændringer, ikke kemiske ændringer. De ændrer ikke stoffets kemiske sammensætning.
Praktiske applikationer
* Madlavning: Vi bruger kogepunkter til at koge mad, og forstå, at vand koger ved en lavere temperatur i højere højder.
* Vejr: Frysningspunktet for vand bestemmer, når det vender sig til is, der påvirker vejrmønstre.
* Kemi: Kogende og frysepunkter hjælper med at identificere stoffer og bestemme deres renhed.
Fortæl mig, hvis du har andre spørgsmål!
 Varme artikler
Varme artikler
-
 Hvordan rentvandsteknologier kunne få et løft fra røntgensynkrotronerKredit:George Hodan/public domain Verden har brug for rent vand, og dets behov vil kun vokse i de kommende årtier. Alligevel er afsaltning og andre vandrensende teknologier ofte dyre og kræver meg
Hvordan rentvandsteknologier kunne få et løft fra røntgensynkrotronerKredit:George Hodan/public domain Verden har brug for rent vand, og dets behov vil kun vokse i de kommende årtier. Alligevel er afsaltning og andre vandrensende teknologier ofte dyre og kræver meg -
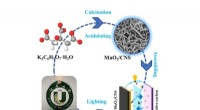 Carbon nanoark som en kompetent assistent til mangandioxid viser bemærkelsesværdig ydeevne i super…Kredit:Higher Education Press I forbindelse med kulstofneutralitet har superkondensatorer, som en ny grøn energilagringsenhed, vist fordele såsom hurtig opladning og afladning, høj effekttæthed og
Carbon nanoark som en kompetent assistent til mangandioxid viser bemærkelsesværdig ydeevne i super…Kredit:Higher Education Press I forbindelse med kulstofneutralitet har superkondensatorer, som en ny grøn energilagringsenhed, vist fordele såsom hurtig opladning og afladning, høj effekttæthed og -
 Kunstigt lungekræftvæv kan hjælpe med at finde nye lægemiddelbehandlinger3D -hydrogel oprettet i universitetsprofessor Molly Shochets laboratorium blev modelleret til at efterligne miljøet for lungekræft, muliggøre mere effektiv og hurtigere lægemiddelscreening. Kredit:Rob
Kunstigt lungekræftvæv kan hjælpe med at finde nye lægemiddelbehandlinger3D -hydrogel oprettet i universitetsprofessor Molly Shochets laboratorium blev modelleret til at efterligne miljøet for lungekræft, muliggøre mere effektiv og hurtigere lægemiddelscreening. Kredit:Rob -
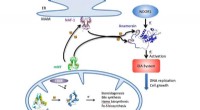 MiNT -protein et nyt mål for at angribe sygdomEn illustration skitserer NEET-cyklussen i celler, hvormed jern-svovlklynger leveres af MiNT, mitoNEET (mNT) og NAF-1 proteiner i cytosolen eller mitokondrierne (bunden) til en række cellulære metabol
MiNT -protein et nyt mål for at angribe sygdomEn illustration skitserer NEET-cyklussen i celler, hvormed jern-svovlklynger leveres af MiNT, mitoNEET (mNT) og NAF-1 proteiner i cytosolen eller mitokondrierne (bunden) til en række cellulære metabol
- Kvinder i ledende stillinger udsættes for mere seksuel chikane
- Hvad er 3 grundlæggende komponenter i moderne vindenergisystemer?
- Voksfyldt nanotech-garn opfører sig som kraftfuldt, superstærk muskel (med video)
- Hvilke vulkaner findes i divergerende pladegrænser?
- Hvad ville en miljøgeogpher undersøgelse?
- Hvad kaldes når Jorden vender væk fra solen?


