Hvad er lighederne mellem kaliumnitrat og chlorid?
1. Begge er ioniske forbindelser: De dannes af den elektrostatiske tiltrækning mellem positivt ladede kaliumioner (K⁺) og negativt ladede ioner (nitrat (NO₃⁻) eller chlorid (CL⁻)).
2. Begge er opløselige i vand: De opløses let i vand og danner vandige opløsninger.
3. Begge indeholder kalium: De indeholder begge kalium (K) som en kation.
4. Begge er hvide faste stoffer: De er begge krystallinske faste stoffer, der forekommer hvide i deres rene form.
5. Begge bruges i gødning: De bruges som kilder til kalium, et essentielt næringsstof til plantevækst.
De har dog også nogle signifikante forskelle:
1. Anion: Anionerne er forskellige. Kaliumnitrat indeholder nitrationen (NO₃⁻), mens kaliumchlorid indeholder chloridionen (CL⁻).
2. Oxidation siger: Nitrogenet i nitrationen har en oxidationstilstand på +5, mens kloren i chloridionen har en oxidationstilstand på -1.
3. Kemiske egenskaber: Deres kemiske egenskaber er forskellige. Kaliumnitrat er en oxidation, mens kaliumchlorid ikke er det. Kaliumnitrat kan nedbrydes til dannelse af kaliumnitrit, ilt og nitrogenoxider, mens kaliumchlorid ikke nedbrydes let.
4. Anvendelser: Kaliumnitrat har en bredere række anvendelser end kaliumchlorid. Udover at være en gødning bruges det også i eksplosiver, fyrværkeri og fødevarekonserveringsmidler. Kaliumchlorid bruges primært som en gødning og i nogle medicinske anvendelser.
Sammenfattende er kaliumnitrat og kaliumchlorid begge kaliumsalte, men deres forskellige anioner giver dem forskellige kemiske egenskaber og en række forskellige anvendelser.
 Varme artikler
Varme artikler
-
 Magnetiske tænder afsløret ved hjælp af kvantebillederAcanthopleura hirtosa chiton radula. Den fulde radula består af 73 tænder med forskellige stadier af mineralisering. Billedet ovenfor viser tænderne før og efter starten af magnetitmineralisering. D
Magnetiske tænder afsløret ved hjælp af kvantebillederAcanthopleura hirtosa chiton radula. Den fulde radula består af 73 tænder med forskellige stadier af mineralisering. Billedet ovenfor viser tænderne før og efter starten af magnetitmineralisering. D -
 Sensoren registrerer lugt af dårlig åndeKredit:American Chemical Society Har du nogensinde ønsket, at du kunne lave et hurtigt åndedrætstjek før et vigtigt møde eller en stor date? Nu forskere, rapportering i ACS journal Analytisk kemi
Sensoren registrerer lugt af dårlig åndeKredit:American Chemical Society Har du nogensinde ønsket, at du kunne lave et hurtigt åndedrætstjek før et vigtigt møde eller en stor date? Nu forskere, rapportering i ACS journal Analytisk kemi -
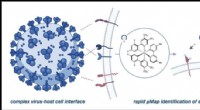 Forskere identificerer flere mulige indgangspunkter for COVID-spidsproteinVærtscelle- og virusgrænsefladen kan være kompleks og involvere mange proteiner, men µMap muliggør direkte undersøgelse af funktionelt vigtige interaktioner. Kredit:Saori Suzuki et al., Journal of the
Forskere identificerer flere mulige indgangspunkter for COVID-spidsproteinVærtscelle- og virusgrænsefladen kan være kompleks og involvere mange proteiner, men µMap muliggør direkte undersøgelse af funktionelt vigtige interaktioner. Kredit:Saori Suzuki et al., Journal of the -
 Forskere udvikler en ny proces, der gør affald til kosttilskudNUS-forskerholdet ledet af lektor Yan Ning (til venstre) og adjunkt Zhou Kang (til højre) har udviklet en integreret upcycling-proces til at producere højværdi aminosyrer fra affaldsmaterialer. Kredit
Forskere udvikler en ny proces, der gør affald til kosttilskudNUS-forskerholdet ledet af lektor Yan Ning (til venstre) og adjunkt Zhou Kang (til højre) har udviklet en integreret upcycling-proces til at producere højværdi aminosyrer fra affaldsmaterialer. Kredit


