Hvilke typer kemiske bindinger er involveret i at opretholde den sekundære struktur et protein?
Her er en sammenbrud:
* alfa-helix: Hydrogenbindingerne dannes mellem carbonyl -ilt af en aminosyrerest og amidhydrogenet i aminosyreresten fire positioner ned i kæden. Dette skaber en spiralformet struktur.
* beta-ark: Hydrogenbindingerne dannes mellem carbonyloxygener og amidhydrogener af tilstødende polypeptidkæder, der kører på en parallel eller anti-parallel mode, hvilket resulterer i en arklignende struktur.
Mens brintbindinger er den primære drivkraft for sekundær struktur, kan andre interaktioner også bidrage, såsom:
* ioniske interaktioner: Disse forekommer mellem ladede aminosyresidekæder.
* Hydrofobe interaktioner: Disse forekommer mellem ikke -polære aminosyresidekæder og skubber dem sammen og væk fra vandet.
* van der Waals Forces: Dette er svage attraktioner mellem molekyler, men de kan kollektivt bidrage til stabiliteten i sekundære strukturer.
Det er vigtigt at bemærke, at disse interaktioner er svagere end kovalente bindinger, men de er stadig afgørende for at opretholde den specifikke form og stabilitet af proteinets sekundære struktur.
Sidste artikelHvad er pH -niveauet for sherry eddike?
Næste artikelHvor mange mol H2O produceres, når 1 mol MGOH2 reagerer med H2SO4?
 Varme artikler
Varme artikler
-
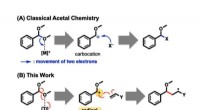 Radikal kemi muliggør ligetil syntese af ethereFigur 1. Aktiveringstilstand for acetaler. (A) Klassisk, acetal C-O-bindinger spaltes på heterolytisk vis. To elektroner, der udgør en C-O-binding, fjernes begge af en sur aktivator ([M]+) for at tilv
Radikal kemi muliggør ligetil syntese af ethereFigur 1. Aktiveringstilstand for acetaler. (A) Klassisk, acetal C-O-bindinger spaltes på heterolytisk vis. To elektroner, der udgør en C-O-binding, fjernes begge af en sur aktivator ([M]+) for at tilv -
 Levende cellemembraner kan selvsortere deres komponenter ved afblandingFaseadskillelse i en syntetisk membran. Kredit:Caitlin Cornell/University of Washington Celler - byggestenene i vores kroppe - er indkapslet af membraner. Det samme gælder de specialiserede rum i
Levende cellemembraner kan selvsortere deres komponenter ved afblandingFaseadskillelse i en syntetisk membran. Kredit:Caitlin Cornell/University of Washington Celler - byggestenene i vores kroppe - er indkapslet af membraner. Det samme gælder de specialiserede rum i -
 Hydrogelbaserede elektroder til hjerneimplantater udvikletPrøve af hydrogel udviklet. Kredit:Kizkitza Gonzalez / UPV / EHU Hydrogeler er fysiske og kemiske polymernetværk, der er i stand til at tilbageholde store mængder væske under vandige forhold uden
Hydrogelbaserede elektroder til hjerneimplantater udvikletPrøve af hydrogel udviklet. Kredit:Kizkitza Gonzalez / UPV / EHU Hydrogeler er fysiske og kemiske polymernetværk, der er i stand til at tilbageholde store mængder væske under vandige forhold uden -
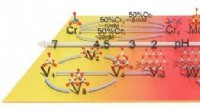 Karakteriseringsstrategi hjælper med metalseparation af høj renhedDet korte udviklingsdiagram over metalspecieringstransformation. Kredit:IPE Metaller med lignende kemiske egenskaber ekstraheres normalt sammen, begrænser dyb adskillelse for metal med høj renhed.
Karakteriseringsstrategi hjælper med metalseparation af høj renhedDet korte udviklingsdiagram over metalspecieringstransformation. Kredit:IPE Metaller med lignende kemiske egenskaber ekstraheres normalt sammen, begrænser dyb adskillelse for metal med høj renhed.
- Vi abonnerer på film og musik, hvorfor ikke transport?
- Hvad er forholdet mellem anabolisme metabolisme og katabolisme?
- Hvad er egenskaberne ved opløsning i sukker?
- Forskere gør fremskridt inden for afsaltningsteknologi
- Sådan ændres decimaler i blandede numre
- Ude af denne verden:Inde i Japans rumkolonicenter


