Hvorfor ville mindre partikler fremskynde en kemisk reaktion?
1. Øget overfladeareal: Mindre partikler har et større forhold mellem overfladeareal og volumen. Dette betyder, at der er flere muligheder for reaktantmolekyler til at komme i kontakt med hinanden, hvilket øger hyppigheden af kollisioner. Jo flere kollisioner, desto mere sandsynligt er det, at der vil forekomme en vellykket reaktion.
2. Øget diffusionshastighed: Mindre partikler diffunderer hurtigere på grund af deres lavere masse. Dette giver dem mulighed for at bevæge sig hurtigere rundt og finde hinanden lettere. Den hurtigere diffusionshastighed øger sandsynligheden for kollisioner mellem reaktantmolekyler.
3. Nedsat diffusionsafstand: Jo mindre partiklerne, jo kortere er afstandsreaktanterne nødt til at rejse for at møde hinanden. Dette reducerer den tid, det tager for molekyler at finde hinanden og reagere, hvilket fremskynder reaktionen.
4. Forbedret reaktivitet: Mindre partikler har ofte en højere overfladeenergi, hvilket gør dem mere reaktive. Dette kan også bidrage til en hurtigere reaktionshastighed.
Eksempler:
* pulveriseret sukker opløses hurtigere end granuleret sukker: Dette skyldes, at det pulveriserede sukker har et meget større overfladeareal, hvilket gør det muligt for vandmolekyler at kontakte og opløse sukkeret hurtigere.
* forbrænding af et stykke træ vs. savsmuld: Sawduld brænder hurtigere end et stykke træ, fordi savsmuld har et større overfladeareal udsat for ilt, hvilket øger forbrændingshastigheden.
* heterogen katalyse: Katalysatorer fungerer ofte ved at tilvejebringe en overflade til, at reaktioner kan forekomme. Mindre partikler af en katalysator tilbyder et større overfladeareal for reaktanterne at interagere med, hvilket fremskynder reaktionen.
Kortfattet:
Mindre partikler fremskynder kemiske reaktioner ved at øge overfladearealet, forbedre diffusionshastigheden, reducere diffusionsafstand og undertiden ved at forbedre reaktiviteten. Dette fører til hyppigere og effektive kollisioner mellem reaktantmolekyler, hvilket i sidste ende resulterer i en hurtigere reaktion.
 Varme artikler
Varme artikler
-
 Kulstofaffald fra stålproduktion kan genanvendes til nye produkterFigur 1:At vide, hvordan en nikkeljernsulfidkatalysator hjælper med at reducere kuldioxid til kulilte og andre kulbaserede produkter, kan føre til teknologier, der kan omdanne kuldioxid i atmosfæren t
Kulstofaffald fra stålproduktion kan genanvendes til nye produkterFigur 1:At vide, hvordan en nikkeljernsulfidkatalysator hjælper med at reducere kuldioxid til kulilte og andre kulbaserede produkter, kan føre til teknologier, der kan omdanne kuldioxid i atmosfæren t -
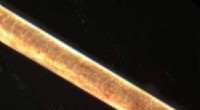 En ny komposit til trækstyrkeStrand af menneskehår ved 200x forstørrelse. Kredit:Jan Homann/Wikipedia Materialeforskere er altid på udkig efter nye kompositter, materialer omfattende to eller flere forskellige stoffer, der ko
En ny komposit til trækstyrkeStrand af menneskehår ved 200x forstørrelse. Kredit:Jan Homann/Wikipedia Materialeforskere er altid på udkig efter nye kompositter, materialer omfattende to eller flere forskellige stoffer, der ko -
 Frysetørrede jordbær og is giver et meget stabilt forholdKredit:CC0 Public Domain ARS-forskere har vist, at nogle frysetørrede bærpulvere - især frysetørret jordbærpulver - kan fungere som fremragende stabilisatorer i is og andre frosne mejerideesserter
Frysetørrede jordbær og is giver et meget stabilt forholdKredit:CC0 Public Domain ARS-forskere har vist, at nogle frysetørrede bærpulvere - især frysetørret jordbærpulver - kan fungere som fremragende stabilisatorer i is og andre frosne mejerideesserter -
 En gel der ikke går i stykker eller tørrer udFigur 1:Diagram over det uorganiske/organiske dobbeltnetværk i den stærke iongel, demonstrationer af dens modstandsdygtighed (kompressionstest, stræktest) og formbarhed (film, rør, fiskens form). Kred
En gel der ikke går i stykker eller tørrer udFigur 1:Diagram over det uorganiske/organiske dobbeltnetværk i den stærke iongel, demonstrationer af dens modstandsdygtighed (kompressionstest, stræktest) og formbarhed (film, rør, fiskens form). Kred
- Hvad har jordskælv vulkaner mineralaflejringer Havgraver og bjergkæder alle har til fælles?
- For 50 år siden, ved Lake Mungo, den sande skala af aboriginernes episke historie blev afsløret
- Hvad bruger vi til at bestemme hårdheden af et mineral?
- Sådan bedømmes matematikpapirer Fast
- Hvad er PayPals første solo-træk?
- Pilotskalaanlæg til udvinding af sjældne jordartselementer i hjertet af kullandet


