Hvilken type bindinger dannes elementet klor?
ioniske bindinger:
* Klor danner let ioniske bindinger med metaller, især alkalimetaller og alkaliske jordmetaller.
* Det får en elektron for at opnå en stabil octet-elektronkonfiguration og danner en chloridion (Cl-).
* Eksempler:NaCl (natriumchlorid), KCL (kaliumchlorid), MgCl2 (magnesiumchlorid).
kovalente obligationer:
* Klor danner også kovalente bindinger med andre ikke -metaller, der deler elektroner for at opnå en stabil octet.
* Det danner typisk enkelt kovalente bindinger, der deler et elektron med et andet atom.
* Eksempler:HCI (hydrogenchlorid), Cl2 (chlorgas), CCL4 (carbon tetrachlorid).
Sammendrag:
* Klor danner let ioniske bindinger med metaller.
* Klor danner kovalente bindinger med ikke -metaller.
Det er vigtigt at bemærke, at klor også kan deltage i andre typer bindinger, såsom hydrogenbinding, men disse er mindre almindelige end ioniske og kovalente bindinger.
Sidste artikelHvad er de to hovedpraksis, der hjælper med at løse kemi -problemer?
Næste artikelDanner kulstof normalt ioniske bindinger?
 Varme artikler
Varme artikler
-
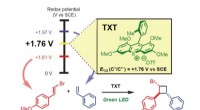 Lys skinner på kemisk produktionsmetodeBilledet illustrerer redoxpotentialet kontrolleret selektiv oxidation af styrener til regio- og stereoselektiv krydsede intermolekylære [2 + 2] cycloaddition via organophotoredox katalyse. Kredit:Yuji
Lys skinner på kemisk produktionsmetodeBilledet illustrerer redoxpotentialet kontrolleret selektiv oxidation af styrener til regio- og stereoselektiv krydsede intermolekylære [2 + 2] cycloaddition via organophotoredox katalyse. Kredit:Yuji -
 Forbløffende effekt muliggør bedre palladiumkatalysatorerSe ind i ultrahøjvakuumkammeret (katalysatorprøve i midten). Kredit:Vienna University of Technology I kemi, atomer kan normalt kun påvirke deres umiddelbare naboskab. På TU Wien, en ny effekt med
Forbløffende effekt muliggør bedre palladiumkatalysatorerSe ind i ultrahøjvakuumkammeret (katalysatorprøve i midten). Kredit:Vienna University of Technology I kemi, atomer kan normalt kun påvirke deres umiddelbare naboskab. På TU Wien, en ny effekt med -
 En ny guldalder for elektronik?Samariumsulfid doteret med forskellige sjældne jordarters grundstoffer krymper, når temperaturen stiger fra omkring minus 175°C til omkring 40-60°C. Her er vist den relative lineære krympning i forhol
En ny guldalder for elektronik?Samariumsulfid doteret med forskellige sjældne jordarters grundstoffer krymper, når temperaturen stiger fra omkring minus 175°C til omkring 40-60°C. Her er vist den relative lineære krympning i forhol -
 Ny proces kan forlænge metallernes levetidKredit:Skylar Kang fra Pexels Stærkere, lettere, billigere materialer er navnet på spillet i avanceret fremstilling. At holde omkostningerne nede på materialer, der er ens, hvis ikke mere, effekti
Ny proces kan forlænge metallernes levetidKredit:Skylar Kang fra Pexels Stærkere, lettere, billigere materialer er navnet på spillet i avanceret fremstilling. At holde omkostningerne nede på materialer, der er ens, hvis ikke mere, effekti
- Hvad er Jan Evangelista Purkinje bidrag til biologi?
- 18 cm svarer til hvor mange mm?
- Hvordan søhesten kunne have fået sin form
- Appelsinskræller kan holde hemmelighed for luftbåren medicin, sikrere broer
- Hvilket element er ikke ædle gasser?
- Ny forskning kan betyde hurtigere computere og bedre mobiltelefoner


