Hvad er oxidationen af XEOF4?
Forståelse af oxidationstilstande
* Oxidationstilstand er den hypotetiske ladning, som et atom ville have, hvis alle dens bindinger var 100% ioniske.
* fluor (f) Har altid en oxidationstilstand på -1 i sine forbindelser.
* ilt (O) har normalt en oxidationstilstand på -2, undtagen i peroxider (hvor det er -1).
Anvendelse af reglerne
1. Tildel oxidationstilstande til F og O:
* Der er fire fluoratomer (4 x -1 =-4)
* Der er et iltatom (-2)
2. Lad oxidationstilstanden af XE være 'X'.
3. Opret en ligning:
* x + (-4) + (-2) =0 (summen af oxidationstilstande i et neutralt molekyle er nul)
4. Løs for 'x':
* x - 6 =0
* x =+6
Derfor er oxidationstilstanden Xe i Xeof₄ +6.
 Varme artikler
Varme artikler
-
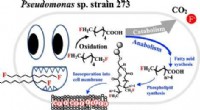 En naturligt forekommende jordbakterie kan give en løsning på evige kemikalierGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.2c01454 University of Tennessee, Knoxville-fakultetets medlemmer Shawn Campagna, professor og associeret afdel
En naturligt forekommende jordbakterie kan give en løsning på evige kemikalierGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.2c01454 University of Tennessee, Knoxville-fakultetets medlemmer Shawn Campagna, professor og associeret afdel -
 Naturligt silica-baseret pesticid beskytter afgrøder i opbevaring og kan fjerne giftig fosfinKredit:petrmalinak, Shutterstock Majs, hvede og ris udgør 90 procent af kornproduktionen globalt, og omkring 40 procent af alle kalorier i forbrugt mad. Men op til halvdelen af de høstede korn,
Naturligt silica-baseret pesticid beskytter afgrøder i opbevaring og kan fjerne giftig fosfinKredit:petrmalinak, Shutterstock Majs, hvede og ris udgør 90 procent af kornproduktionen globalt, og omkring 40 procent af alle kalorier i forbrugt mad. Men op til halvdelen af de høstede korn, -
 Stampede2, Bridges-simuleringer viser svage punkter i ebola-virusnukleocapsidDen dødelige ebola-virus beskytter sit RNA-genetiske materiale i spoler af proteiner kaldet nukleokapsider (ovenfor). Juan Perillas laboratorium ved University of Delaware gennemførte simuleringer af
Stampede2, Bridges-simuleringer viser svage punkter i ebola-virusnukleocapsidDen dødelige ebola-virus beskytter sit RNA-genetiske materiale i spoler af proteiner kaldet nukleokapsider (ovenfor). Juan Perillas laboratorium ved University of Delaware gennemførte simuleringer af -
 En nanoteknologisk sensor, der forvandler molekylære fingeraftryk til stregkoderForfatterne viser en pixeleret sensormetasurface til molekylær spektroskopi. Den består af metapixels designet til at koncentrere lys til nanometerstore volumener for at amplificere og detektere absor
En nanoteknologisk sensor, der forvandler molekylære fingeraftryk til stregkoderForfatterne viser en pixeleret sensormetasurface til molekylær spektroskopi. Den består af metapixels designet til at koncentrere lys til nanometerstore volumener for at amplificere og detektere absor
- Hvor er verdens største plastfabrik?
- Modellering afdækker en atomvals til atommanipulation
- Lyndata mere nyttige end tidligere antaget
- En ny knap til at styre og skabe højere harmoniske i faste stoffer
- Færre bilrejser og flere flyrejser:Hvordan COVID-19 har ændret måden, vi rejser på
- Hvordan fungerer en vejrballon?


