Hvilke elementer danner ofte kovalente bindinger?
Her er hvorfor:
* Elektronegativitet: Ikke -metaller har generelt høj elektronegativitet, hvilket betyder, at de har en stærk tiltrækning for elektroner. Det er mindre tilbøjelige til at miste elektroner og mere tilbøjelige til at dele dem for at opnå en stabil elektronkonfiguration.
* Deling af elektroner: Kovalent binding involverer deling af elektroner mellem atomer for at danne et stabilt molekyle. Ikke-metaller er velegnet til denne type binding, fordi de kan opnå en fuld ydre skal af elektroner ved at dele.
Almindelige eksempler på elementer, der danner kovalente obligationer, inkluderer:
* gruppe 14 (Carbon Group): Carbon (C), Silicon (SI), Germanium (GE)
* gruppe 15 (nitrogengruppe): Nitrogen (N), fosfor (P), arsen (AS)
* gruppe 16 (Oxygen Group): Oxygen (O), svovl (er), selen (SE)
* gruppe 17 (halogener): Fluor (F), klor (CL), brom (BR), iod (I)
Vigtig note:
Mens ikke -metaller overvejende danner kovalente obligationer, er der nogle undtagelser. For eksempel er brint (H) en ikke -metal, men det kan også danne ioniske bindinger med meget elektronegative elementer som ilt (O) til dannelse af vand (H₂O).
Fortæl mig, hvis du gerne vil have flere detaljer om specifikke kovalente bindingstyper eller eksempler!
 Varme artikler
Varme artikler
-
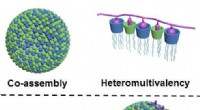 Kemikere udvikler ny metode til selektiv binding af proteinerFigur øverst:Gennem sammontering, to komponenter af lipidtypen danner nano-partikler i vand, som har et meget stort antal forskellige kontaktpunkter (vist med blå og grøn; til venstre). Som et resulta
Kemikere udvikler ny metode til selektiv binding af proteinerFigur øverst:Gennem sammontering, to komponenter af lipidtypen danner nano-partikler i vand, som har et meget stort antal forskellige kontaktpunkter (vist med blå og grøn; til venstre). Som et resulta -
 Ny biokemisk vej, der kan udvikle mere modstandsdygtige afgrødesorterKredit:CC0 Public Domain Forskere fra Institut for Plantevidenskab, University of Oxford, har opdaget en ny biokemisk vej i planter, som de har kaldt CHLORAD. Ved at manipulere CHLORAD-vejen, for
Ny biokemisk vej, der kan udvikle mere modstandsdygtige afgrødesorterKredit:CC0 Public Domain Forskere fra Institut for Plantevidenskab, University of Oxford, har opdaget en ny biokemisk vej i planter, som de har kaldt CHLORAD. Ved at manipulere CHLORAD-vejen, for -
 Structure-ID teknik kunne skifte kemi til fordrejningshastighedMichael Martynowycz, en postdoktor i Tamir Gonens laboratorium, køler en prøve med flydende nitrogen som forberedelse til et MicroED-eksperiment, der vil afsløre prøvens molekylære struktur. Kredit:Ta
Structure-ID teknik kunne skifte kemi til fordrejningshastighedMichael Martynowycz, en postdoktor i Tamir Gonens laboratorium, køler en prøve med flydende nitrogen som forberedelse til et MicroED-eksperiment, der vil afsløre prøvens molekylære struktur. Kredit:Ta -
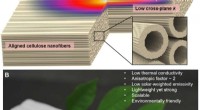 Dette er nanowood, en opfindelse, der kunne reducere menneskehedens CO2-fodaftrykFuldstændig afledt af naturligt træ, nanowood med hierarkisk justerede cellulose nanofibriller kan bruges som en anisotrop super termisk isolator. (A) Skema af de termisk isolerende egenskaber af nano
Dette er nanowood, en opfindelse, der kunne reducere menneskehedens CO2-fodaftrykFuldstændig afledt af naturligt træ, nanowood med hierarkisk justerede cellulose nanofibriller kan bruges som en anisotrop super termisk isolator. (A) Skema af de termisk isolerende egenskaber af nano
- Fremtrædende videnskabsmænd 160 år gamle teorier hjælper med at opdage lysbølger
- Tre positive effekter af Going Green
- Netflix opretter 100 millioner dollars virushjælpskasse
- Er drivere til Amazon, Lyft eller Ubers dagens version af fabriksarbejdere?
- Hvordan organtransplantationer virker
- En mus eller en elefant:hvilken art bekæmper infektion mere effektivt?


