Kemikere udvikler ny metode til selektiv binding af proteiner
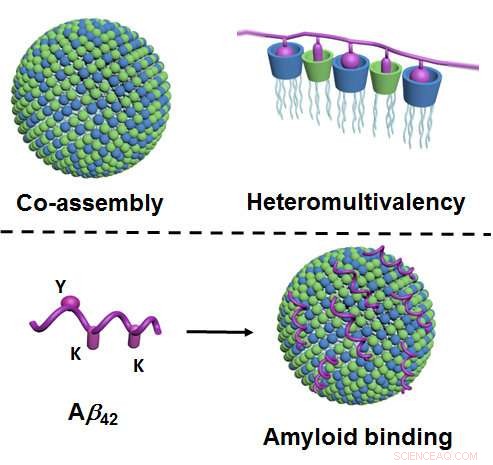
Figur øverst:Gennem sammontering, to komponenter af lipidtypen danner nano-partikler i vand, som har et meget stort antal forskellige kontaktpunkter (vist med blå og grøn; til venstre). Som et resultat af mange forskellige kontaktpunkter, der interagerer samtidigt med proteinet (vist i violet), en særlig høj grad af selektivitet forekommer ("heteromultivalens", ret). Figur nederst:Via deres kontaktpunkter (grøn og blå), nanopartiklerne binder amyloiderne - her, specifikt, amyloid-beta 42 (violet), og dermed forhindre deres aggregering. Binding foregår via de tilsvarende kontaktpunkter på amyloidet ("Y" og "K"; til venstre). Kredit:University of Münster - Bart Jan Ravoo
En ny metode til selektivt at binde proteiner til nanopartikler er blevet beskrevet af et team af tyske og kinesiske forskere under ledelse af prof. Bart Jan Ravoo, en kemiker ved universitetet i Münster (Tyskland). Nanopartiklerne genkender automatisk specifikke peptider, dvs. små proteiner, og indgå i meget selektiv binding med dem. Blandt de modelpeptider, forskerne undersøgte, var amyloider. Indskud af amyloider spiller en stor rolle i Alzheimers sygdom, for eksempel, så håber forskerne, at den mekanisme, de har opdaget, kan give en ny tilgang til behandling af sygdomme, hvor sådanne aflejringer forekommer. Undersøgelsen er blevet offentliggjort i det seneste nummer af Naturkemi.
Samspillet mellem proteinmolekyler eller mellem dem og andre biomolekyler spiller en stor rolle i rigtig mange fysiologiske processer. I denne sammenhæng, molekylær genkendelse indebærer binding af proteiner gennem flere kontaktpunkter på nanoskala på overfladen af proteinet. Typisk, rigtig mange af disse punkter er involveret, resulterer i en unik, præcis og komplementær kontaktflade. Mekanismen, disse proteinmolekyler binder, beskrives derfor som et "nøgle-og-lås-princip". Forskerne har nu beskrevet en metode til fremstilling af sådanne kontaktflader på nanopartikler, så udvalgte proteiner kan målrettes og bindes.
Samling og "heteromultivalens"
Det nye ved metoden er, at den er baseret på principperne for samsamling og såkaldt heteromultivalens. Samsamling betyder, at nanopartiklerne ikke-som normalt er-fremstilles som følge af kompleks og skræddersyet kemisk syntese. I stedet, forskerne producerer dem ved hjælp af en forholdsvis enkel metode, hvor to lipid-type ("fede") komponenter blandes i vand og spontant danner de nødvendige nanopartikler. Disse partikler er adaptive, dvs. de ændrer deres indre struktur og opnår dermed optimal binding til målproteinet. "Heteromultivalens" betyder, at nanopartiklerne danner et meget stort antal forskellige kontaktpunkter, som, på samme tid, interagere med proteinet. Efter eksemplet med naturlige fysiologiske processer, en særlig høj selektivitet forekommer således.
"Indtil nu, især dette princip om heteromultivalens er næppe blevet undersøgt detaljeret eller udnyttet, "siger Bart Jan Ravoo." Vi beskriver en helt ny tilgang, som vil gøre det muligt at udvikle yderligere syntetiske proteinbindere. Dette kan overvejes til brug til diagnostik eller billeddannelse - eller som potentielle aktive ingredienser i medicin. "Forskerne har vist, at nanopartiklerne binder sig til amyloider og, som resultat, opløse aggregater af disse peptider. Forekomsten af amyloidaggregater er tæt forbundet med udviklingen af Alzheimers. Det er derfor, den nye metode kan give en tilgang til udvikling af nye behandlingstyper. Det er endnu ikke afklaret, imidlertid, om amyloidaggregaterne virkelig forårsager Alzheimers eller er, hellere, et resultat af sygdommen. I øvrigt, den nye metode til opløsning af aggregaterne er kun blevet afprøvet i et reagensglas. Yderligere undersøgelser er derfor nødvendige for mere klart at vurdere dets potentiale som en tilgang til behandling.
Metoden
Forskerne brugte amfifile, vandopløselige cyclodextrin- og calixarenmolekyler som samlingskomponenter til nano-kontaktpunkterne. De undersøgte bindingen af de resulterende nanopartikler til peptiderne, ved hjælp af f.eks. fluorescensspektroskopi. De brugte elektronmikroskopi til at demonstrere binding til amyloiderne.
 Varme artikler
Varme artikler
-
 Strækbare superkondensatorer til at drive morgendagens bærbare enhederDisse skovlignende rækker af kulstofnanorør blev skabt på et elastomersubstrat, der blev forstrakt i én retning og derefter fik lov til at trække sig sammen. Denne proces skaber strækbare superkondens
Strækbare superkondensatorer til at drive morgendagens bærbare enhederDisse skovlignende rækker af kulstofnanorør blev skabt på et elastomersubstrat, der blev forstrakt i én retning og derefter fik lov til at trække sig sammen. Denne proces skaber strækbare superkondens -
 For CRISPR, justering af DNA-fragmenter før indsættelse giver de højeste effektivitetsrater endnuProfessor Huimin Zhao ledede et team, der opnåede den højeste rapporterede effektivitet ved at indsætte gener i humane celler med CRISPR-Cas9. Kredit:L. Brian Stauffer Forskere fra University of I
For CRISPR, justering af DNA-fragmenter før indsættelse giver de højeste effektivitetsrater endnuProfessor Huimin Zhao ledede et team, der opnåede den højeste rapporterede effektivitet ved at indsætte gener i humane celler med CRISPR-Cas9. Kredit:L. Brian Stauffer Forskere fra University of I -
 Forskere udløser enzymer med lysI modellen:blåt lys udløser en særlig monooxygenasereaktion i et enzym. Denne form for aktivering var hidtil ukendt i enzymologien. Kredit:Steffen L. Drees Enzymer er de centrale drivkræfter for b
Forskere udløser enzymer med lysI modellen:blåt lys udløser en særlig monooxygenasereaktion i et enzym. Denne form for aktivering var hidtil ukendt i enzymologien. Kredit:Steffen L. Drees Enzymer er de centrale drivkræfter for b -
 Udnyttelse af tabte atomer kan hjælpe med at skabe nye, aldrig før sete oxiderKemisk kortlægning og illustration af atomare omlejring ved grænsefladen mellem to oxidmaterialer (La =lanthan; Sr =strontium). Kredit:PNNL At forstå, hvordan materialer dannes og kombineres med h
Udnyttelse af tabte atomer kan hjælpe med at skabe nye, aldrig før sete oxiderKemisk kortlægning og illustration af atomare omlejring ved grænsefladen mellem to oxidmaterialer (La =lanthan; Sr =strontium). Kredit:PNNL At forstå, hvordan materialer dannes og kombineres med h
- Ny proces indsnævrer kløften mellem naturlige og syntetiske materialer
- Mange midtvestere vil sandsynligvis aldrig tro på klimaændringer. Her er hvordan man kan opmuntre …
- Super invadertræ rammer syd, men loppebille kan være helt
- Stærke magnetfelter ændrer, hvordan friktion fungerer i plasma
- Ny undersøgelse først for at forudsige, hvilke olie- og gasboringer der lækker metan
- En usandsynlig konkurrent til diamant som den bedste termiske leder


